Un marque-page au service de la mémoire mitotique pendant le développement
Pour maintenir les identités cellulaires au cours du développement, les profils d'expression des gènes doivent être fidèlement propagés à travers les générations cellulaires. Cependant les réorganisations majeures de l’information génétique pendant les mitoses représentent un obstacle à cette transmission. En utilisant l'embryon précoce de drosophile comme modèle, cette étude publiée dans la revue Nature Communications, montre que le facteur de transcription GAF joue le rôle de « marque-page » mitotique.
La construction d’un organisme pluricellulaire complexe, à partir d’une cellule-œuf unique, nécessite d’une part de multiples divisions cellulaires, et d’autre part la différenciation de ces cellules en tissus distincts. Dans ce contexte embryonnaire particulier, la régulation de l’expression des gènes du développement doit être précise dans l’espace et dans le temps, afin de dicter aux cellules quel destin adopter. Par ailleurs, une fois un destin cellulaire adopté, il doit être transmis de cellules mères à cellules filles. Un mécanisme potentiel de support de cet héritage pourrait être la mémoire de la transcription des gènes, qui permettrait aux cellules filles d'hériter du statut transcriptionnel de leurs mères à chaque division. Comment pouvons-nous imaginer une telle persistance de l'information ‘identitaire’ au cours des divisions, alors que la plupart des régulateurs transcriptionnels se séparent de leurs gènes cibles pendant la mitose ? A la manière de marques-pages, certains facteurs ont la capacité de rester associés aux chromosomes mitotiques, représentant des supports potentiels de cette mémoire. Dans le cadre d'une collaboration internationale et en utilisant l'embryon précoce de drosophile, les scientifiques ont démontré que le facteur de transcription GAF jouait un rôle de « marque-page » mitotique, favorisant ainsi la mémoire transcriptionnelle.
GAF est un régulateur transcriptionnel aux multiples facettes, important pour l’activation du génome zygotique et l’organisation du génome. Ce facteur de transcription se lie à des motifs "GAGAG", qui peuvent être présents dans le génome sous formes de répétitions
Dans un premier temps, les scientifiques ont démontré que contrairement à la majorité des facteurs de transcription exprimés à ces stades embryonnaires, GAF s’associe aux chromosomes mitotiques. Ils ont ensuite utilisé des techniques d’imagerie quantitatives comme le FRAP (Redistribution de Fluorescence Après Photoblanchiment) et ont ainsi découvert que le facteur GAF était capable de rester lié à ses cibles pendant de longues périodes (minutes, alors que la plupart des facteurs de transcription mobilisent leurs cibles que de manière transitoire, de l’ordre de la seconde). Dans le but de comprendre si cette capacité de GAF à lier ses cibles pendant de longues périodes pouvait lui conférer des propriétés de ‘marque-page’ pendant la mitose, les scientifiques ont ensuite cherché à identifier les cibles liées par GAF pendant la mitose, à l’échelle du génome.
Les chercheurs ont dû développer un protocole permettant de d’obtenir une population pure d’embryons en mitose, et ont ensuite cartographié les cibles de GAF. Il est à noter qu’avant cette étude, les seules données de profilage génomiques en mitose concernaient des cellules en cultures (nécessitant la synchronisation du cycle cellulaire par traitement avec des molécules chimiques).
Les chercheurs ont identifié des milliers de régions liées par GAF en interphase, mais pour 37% d’entre elles, une liaison avec GAF persiste durant la séparation des chromosomes. Ces cibles de GAF particulières, telles les pages d’un livre balisées par des marques-pages, correspondent principalement à des séquences cis-régulatrices de gènes clés du développement. Contrairement aux cibles de GAF seulement liées en interphase, ces cibles liées tout au long du cycle cellulaire possèdent plus de sites de fixation de GAF, suggérant un mode d’action particulier.
Afin d'étudier la cinétique d'activation de ces gènes, les scientifiques se sont concentrés sur quelques gènes de développement, pour lesquels des allèles marqués et pouvant être suivis ont été générés. En utilisant l'imagerie par microscopie confocale d'embryons précoces de drosophile, il est possible de détecter l'état transcriptionnel des cellules et de leur descendance. Cette approche a démontré que le gène du développement scylla, lié par GAF en interphase et en mitose, montrait une mémoire mitotique transcriptionnelle, où l’état transcriptionnel des noyaux mères avant division influençait celui des noyaux filles. Des manipulations génétiques ont permis de montrer que cette mémoire était GAF-dépendante.
En plus d’identifier les cibles et fonctions du régulateur GAF au cours du développement précoce de la drosophile, ce travail met en lumière un processus de repérage d’une partie du génome pendant la mitose. Contrairement aux autres exemples de repérage mitotique, cette étude démontre un mode de repérage par des liaisons stables aux ADN cibles. Ce mode d’action stable est permis par des propriétés cinétiques particulières d’une part et par un arrangement des sites de fixation en répétitions d’autre part. Il sera utile d’étudier si une telle mobilisation stable de cibles en mitose pourrait être mise en œuvre chez les mammifères.
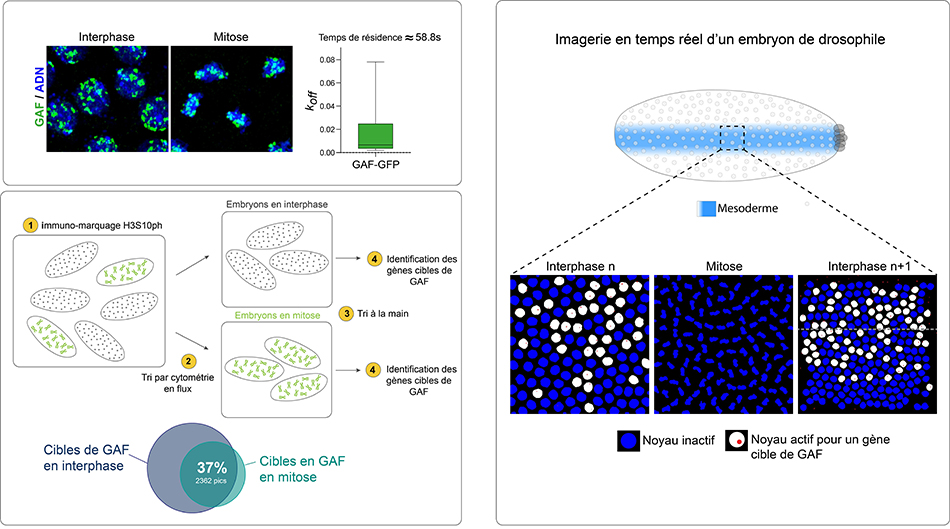
Figure : Le facteur de transcription GAF agit comme un marque-page au cours des mitoses et permet une mémoire transcriptionnelle. Le facteur de transcription GAF s’associe aux chromosomes mitotiques d’un embryon de drosophile et engage ses cibles pendant de longues périodes (temps de résidence de l’ordre de la minute). Identification des cibles de GAF en interphase et en mitose par des expériences d’immunoprécipitation de la chromatine (Chip) sur embryons de drosophile. Étude de la dynamique d’activation du gène scylla par la technique MS2/MCP et imagerie confocale. Quantification de la mémoire transcriptionnelle : comparaison des temps d’activation post-mitotiques, entre noyaux issus de mères transcriptionellement actives et de noyaux voisins, issus de mères inactives.
Un marque-page au service de la mémoire mitotique pendant le développement
Vidéo obtenue par imagerie confocale d’un embryon de drosophile vivant, filmé pendant ses 4 premières heures de vie. Le génome de cet embryon a été modifié par la technique Crispr/Cas9 afin d’y introduire des séquences MS2 au locus du gène développemental ‘scylla’, permettant la visualisation en direct des ARNm naissants de ce gène du développement, au moment et dans les noyaux où ces ARNm sont synthétisés. Les images sont ensuite traitées pour mettre en exergue les noyaux exprimant ces ARNm, colorés en verts (noyaux actifs) et ceux n’exprimant pas ces ARN en rouge (noyaux inactifs). La mémoire transcriptionnelle peut être quantifiée car l’imagerie du vivant donne accès à l’historique de l’activité transcriptionnelle et au lignage. Cette vidéo a été accélérée, les images originales ont une résolution temporelle de 1 image toutes les 20 secondes environ.
Audiodescription
Pour en savoir plus:
The control of transcriptional memory by stable mitotic bookmarking
Maëlle Bellec, Jérémy Dufourt, George Hunt, Hélène Lenden-Hasse, Antonio Trullo, Amal Zine El Aabidine, Marie Lamarque, Marissa M Gaskill, Heloïse Faure-Gautron, Mattias Mannervik, Melissa M Harrison, Jean-Christophe Andrau, Cyril Favard, Ovidiu Radulescu, and Mounia Lagha.
Nature Communications 4 mars 2022. https://doi.org/10.1038/s41467-022-28855-y
Contact
Laboratoire
Institut de Génétique Moléculaire de Montpellier (Université de Montpellier/CNRS)
1919 route de Mende
34090 Montpellier