Fumeurs, fumeuses : la nicotine vous exploite !
La nicotine contenue dans le tabac détourne l’activité des neurones dopaminergiques du système de récompense, ce qui conduit à un renforcement du comportement de prise de drogue puis à l’addiction. Les résultats d'une nouvelle étude chez la souris, publiés dans la revue Nature Communication, indiquent que la nicotine, par son action sur les neurones dopaminergiques, modifie aussi la prise de décisions et des comportements qui ne sont pas directement liés à la recherche ou à la prise de drogue.
La consommation chronique de nicotine, principal agent actif du tabac, entraîne de nombreuses altérations physiologiques et comportementales. En particulier, la nicotine détourne l’activité des neurones de l’aire tegmentale ventrale qui produisent la dopamine (neurones dopaminergiques). Ce noyau cérébral fait partie du circuit de la récompense et joue un rôle prépondérant dans la motivation, la prise de décisions et le renforcement. Par son action sur les neurones dopaminergiques, la nicotine contribue à un renforcement aberrant du comportement de prise de drogue et à l’addiction. Mais en modifiant à long terme l’activité de ces neurones, la nicotine peut également altérer des comportements qui ne sont pas directement liés à la recherche ou à la prise de drogue. Chez les fumeurs, il existe par exemple des différences dans des traits de personnalité impactant la vie quotidienne, tels que l’impulsivité ou l’anxiété. Cependant, il est souvent difficile de savoir si ces différences préexistent au tabagisme, ou si elles sont la conséquence de l’exposition à la nicotine. La nicotine perturbe-t-elle nos choix quotidiens en affectant la façon dont nous attribuons de la valeur aux objets et aux évènements, ou en influençant notre stratégie pour résoudre un problème ?
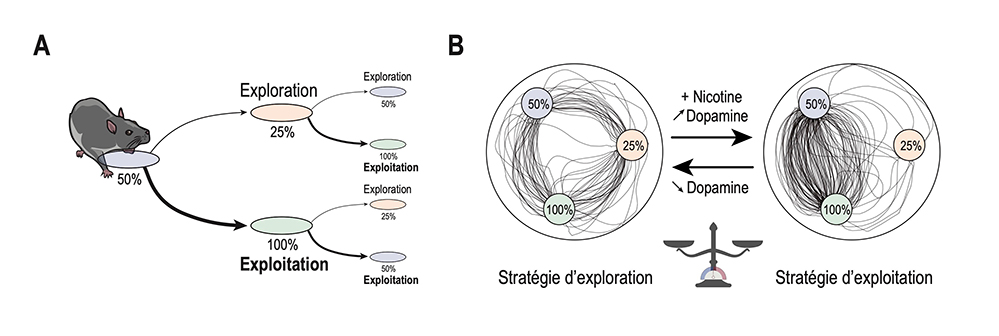
Pour répondre à cette question, des scientifiques ont testé, chez la souris, l’effet d’une exposition chronique à la nicotine sur la prise de décision dans un contexte qui n’est pas lié à la consommation de drogue. Ils ont analysé les choix des animaux dans une expérience mimant les machines à sous d’un casino : en se déplaçant librement dans une arène circulaire, l’animal peut choisir de s'arrêter sur trois petites aires, A, B et C, chacune lui délivrant une récompense avec une probabilité différente (respectivement 100%, 50% ou 25% des cas). Ils ont ainsi mis en évidence plusieurs stratégies, allant de l’exploitation des zones où les probabilités de récompense sont les plus fortes (100% et 50%), à l’exploration, caractérisée par des choix plus variables et une visite plus fréquente des zones associées à des probabilités de récompense plus faibles (50% et surtout, 25 %). Les résultats montrent que les souris exposées à la nicotine développent une préférence pour une stratégie d’exploitation des sites ayant les probabilités de récompense les plus élevées (100% et 50%). Elles adoptent donc un comportement plus optimal que les autres en termes de récompense, mais aux dépens de l'exploration d’options en apparence moins rentables à court terme, mais qui sont pourtant nécessaires pour mieux comprendre l'environnement et s’adapter aux changements à long terme. En outre, les chercheurs montrent que l'exposition chronique de ces animaux à la nicotine produit aussi une augmentation de l’activité spontanée des neurones dopaminergiques. Pour tester si cette augmentation d'activité suffit à impacter les stratégies d’exploitation ou d’exploration des souris, les scientifiques ont utilisé une technique optogénétique pour stimuler ou inhiber artificiellement ces neurones avec de la lumière. La stimulation a rendu les souris plus exploitantes, mimant ainsi les effets observés chez les animaux sous nicotine, tandis que l’inhibition de ces neurones a rendu les souris plus exploratrices.
Ces résultats jettent un nouvel éclairage sur l’addiction au tabac. Ils suggèrent que la nicotine, par son action sur le système dopaminergique, perturbe la perception de la valeur des récompenses ou la stratégie de prise de décisions, influençant ainsi un vaste champ de comportements de choix, y compris ceux ne concernant pas la recherche ou la prise de drogue.
Pour en savoir plus :
Chronic nicotine increases midbrain dopamine neuron activity and biases individual strategies towards reduced exploration in mice.
Dongelmans M, Durand-de Cuttoli R, Nguyen C, Come M, Duranté E.K., Lemoine D, Brito R, Ahmed Yahia T, Mondoloni S, Didienne S, Bousseyrol E, Hannesse B, Reynolds L.M., Torquet N, Dalkara D, Marti F, Mourot A, Naudé J, Faure P
Nat Commun 26 novembre 2021. doi : 10.1038/s41467-021-27268-7
Contact
laboratoire
ESPCI, Laboratoire de plasticité du cerveau, (CNRS/Ecole supérieure de physique et de chimie industrielles de la ville de Paris)
10 rue Vauquelin,
75005 Paris
