Convergence structurale entre des inhibiteurs et un régulateur de la dynamique des microtubules
Les microtubules sont des fibres du cytosquelette dont la dynamique d’assemblage est régulée par différentes familles de protéines. Ils sont également la cible de petits composés dont certains sont utilisés en clinique. Dans une étude publiée dans la revue PNAS, les scientifiques ont montré qu’une région de la protéine CPAP et des métabolites produits par des bactéries ou des champignons partageaient un même mode de liaison à la tubuline. Ces résultats apportent une des premières démonstrations d’une convergence structurale entre des inhibiteurs exogènes et un régulateur cellulaire de la dynamique des microtubules.
Les microtubules sont des assemblages dynamiques qui assurent des fonctions vitales chez les organismes eucaryotes, par exemple lors de la division cellulaire, pour la mise en place des cils et des flagelles, ou encore dans le trafic intracellulaire. Pour remplir ces différentes fonctions, les microtubules se réarrangent pour former différents types de réseaux dynamiques, tels que « l’aster » de microtubules des cellules en interphase ou le fuseau mitotique des cellules en division. Les microtubules forment également des structures bien définies, plus stables, comme les centrioles. La dynamique des microtubules est une propriété intrinsèque de l’hétérodimère alpha-béta de tubuline, qui est la protéine constitutive des microtubules ; elle est cependant régulée dans la cellule par différentes familles de protéines. C’est le cas de la protéine CPAP qui contrôle la longueur des microtubules du centriole. La dynamique des microtubules est également la cible de petits composés exogènes, dont certains sont des médicaments utilisés notamment en chimiothérapie anti-cancéreuse. En règle générale, la question de savoir si les sites de liaison de partenaires cellulaires de la tubuline sont également la cible de petits composés inhibiteurs reste encore peu explorée.
L’une des méthodes de choix pour répondre à ce type de questions est la cristallographie aux rayons X. Cette méthode nécessite de cristalliser l’objet à analyser. Dans le cas de la tubuline, son auto-association en assemblages hétérogènes est un frein à sa cristallisation. Une méthode pour contourner ce problème est d’utiliser des ligands protéiques de la tubuline qui vont empêcher cette auto-association. Mais au démarrage de ce projet en 2004, les chercheurs ne disposaient pas de telle protéine capable de former des assemblages ternaires avec la tubuline et CPAP.
Pour mieux caractériser l’interaction de la tubuline avec CPAP, et en particulier avec son domaine PN2-3 qui a été identifié pour se fixer à la tubuline, les scientifiques ont tiré avantage de la sélection récente de protéines artificielles, appelées alphaReps, pour leur capacité à se fixer à la tubuline-alpha, loin du site présumé de PN2-3. Ils ont ainsi cristallisé des complexes alphaRep:tubuline:PN2‑3 et déterminé leur structure. Les résultats indiquent que la partie N-terminale de PN2-3 se lie au site "vinca" de la tubuline. Ce site est nommé ainsi parce qu’il est la cible de médicaments anticancéreux de la famille des alcaloïdes vinca, dont fait partie la vinblastine (une molécule issue de la pervenche de Madagascar). C’est également le site de fixation de composés pseudo-peptidiques produits par des bactéries ou des champignons et qui inhibent la division cellulaire. De façon remarquable, le mode de liaison à la tubuline de cette région de CPAP et de ces métabolites est très similaire.
Ces résultats apportent une des premières démonstrations d’une convergence structurale entre de petits inhibiteurs exogènes et un régulateur cellulaire de la dynamique des microtubules. Au-delà de ces aspects fondamentaux, ce travail pourra servir de guide pour la conception de nouveaux composés à visée thérapeutique ciblant la dynamique des microtubules.
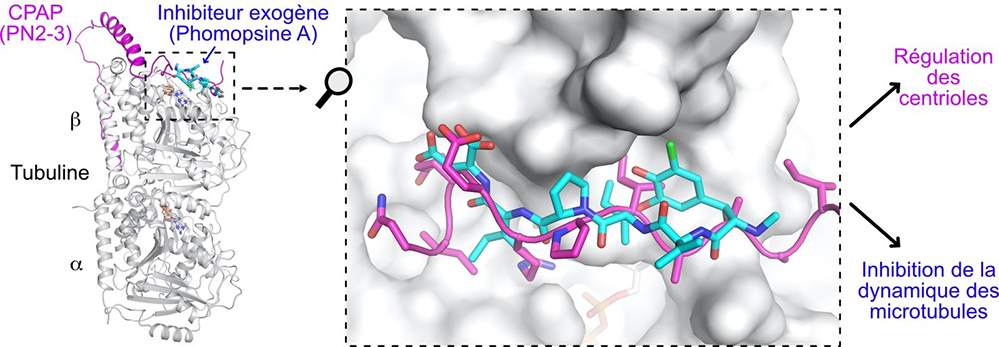
Figure : Une région de la protéine CPAP (en magenta) et la phomopsine A (en cyan) partagent un même mode de fixation à la tubuline mais ont des propriétés différentes. La phomopsine A est un métabolite pseudo-peptidique toxique produit par le champignon Diaporthe toxica qui se développe sur les lupins.
Pour en savoir plus :
Structural convergence for tubulin binding of CPAP and vinca domain microtubule inhibitors.
Campanacci V, Urvoas A, Ammar Khodja L, Aumont-Nicaise M, Noiray M, Lachkar S, Curmi PA, Minard P, Gigant B.
Proc Natl Acad Sci U S A. 10 mai 2022 May doi: 10.1073/pnas.2120098119
Contact
Laboratoire
Institut de biologie intégrative de la cellule (I2BC) (CNRS/Université Paris-Saclay/CEA)
1 Avenue de la Terrasse
91190 Gif-sur-Yvette