Un nouveau mode de réparation des télomères dévoilé
Les télomères sont des structures nucléo-protéiques qui protègent les extrémités des chromosomes et raccourcissent à chaque division cellulaire. Cette érosion naturelle des télomères reflète les divisions successives d’une cellule et constitue un marqueur du vieillissement cellulaire. En utilisant un modèle de levure, Stéphane Coulon et Vincent Géli au Centre de Recherche sur le Cancer de Marseille, révèlent que les télomères érodés sont sujets à des réarrangements chromosomiques dans des cellules quiescentes. De façon remarquable, ces modifications réduisent la capacité de ces cellules à proliférer en sortie de quiescence. Ces travaux ont été publiés le 22 Novembre 2017 dans la revue Nature Communications.
Les divisions cellulaires provoquent un raccourcissement des télomères qui, au delà d’un seuil critique, limite la capacité de prolifération de la plupart des cellules d’un organisme. Les cellules souches embryonnaires et les cellules germinales échappent à cette barrière anti-proliférative car elles expriment la télomérase, une enzyme capable de rallonger les télomères. Chez l’adulte, le raccourcissement des télomères est essentiellement observé dans les cellules somatiques mais aussi dans les cellules souches pour lesquelles l’activité de la télomérase est réduite ou absente. L’attrition naturelle des télomères peut altérer les fonctions des cellules souches en limitant leur capacité à entrer et sortir de la quiescence pour assurer par exemple la régénération des tissus.
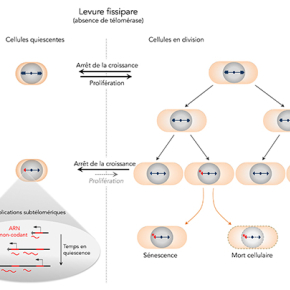
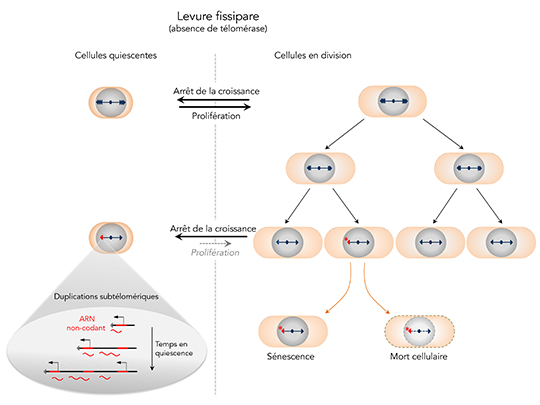
Les mécanismes de maintenance des télomères sont bien étudiés dans les cellules en division mais restent peu connus dans des cellules quiescentes (qui ne se divisent pas). Il a été montré que des dommages sur l’ADN peuvent engendrer un raccourcissement des télomères des cellules quiescentes, notamment dans les neurones et les cellules musculaires. Les chercheurs ont posé la question du devenir des télomères dysfonctionnels dans les cellules quiescentes. Afin d’étudier les mécanismes qui régissent la maintenance des télomères courts dans les cellules quiescentes, ils ont utilisé des cellules de levure dont la quiescence peut être induite métaboliquement. Alors que les télomères d’une souche sauvage sont stables en quiescence, ils ont observé que des télomères érodés sont fortement réarrangés en absence de télomérase. De façon inattendue pour des cellules quiescentes, ces réarrangements correspondent à des duplications de régions subtélomériques.
Ces réarrangements spécifiques qui n’ont jamais été observés précédemment dépendent d’une voie de réparation de l’ADN appelée recombinaison homologue qui opère essentiellement dans des cellules en division. Les chercheurs ont découvert que le mécanisme par lequel ces réarrangements surviennent implique la transcription d’ARN non-codant au niveau de ces régions subtélomériques. De manière surprenante, ces duplications au niveau des régions subtélomériques diminuent la capacité des cellules à initier un nouveau cycle cellulaire.
En résumé, ce travail met en évidence un nouveau mode de réparation des télomères spécifique aux cellules post-mitotiques de levure qui limite la capacité de ces cellules à sortir de quiescence.
© Stéphane Coulon
En savoir plus
-
Eroded telomeres are rearranged in quiescent fission yeast cells through duplications of subtelomeric sequences.
Laetitia Maestroni, Julien Audry, Samah Matmati, Benoit Arcangioli, Vincent Géli & Stéphane Coulon
Nature Communications 8, Article number: 1684 (2017) doi:10.1038/s41467-017-01894-6. Published online: 22 November 2017.