Anémie de Fanconi : une connexion inattendue avec la machinerie d'épissage des ARNs
Vingt et un gènes ont été associés à l'anémie de Fanconi (AF), maladie génétique complexe entrainant un déficit de la moëlle osseuse et une forte prédisposition à développer des tumeurs. Ils codent des protéines mobilisées sur la chromatine lorsque des obstacles entravent la progression des fourches de réplication de l’ADN et ils sont nécessaires à la réparation des pontages inter-caténaires induits par des agents chimiothérapeutiques. María Moriel-Carretero, Sara Ovejero et Angelos Constantinou à l'Institut de génétique humaine, révèlent une connexion inattendue entre des protéines de l'AF et la machinerie de l'épissage des ARNs. Cette étude publiée le 13 octobre 2017 dans la revue Journal of Cell Biology, apporte un nouvel éclairage sur les syndromes myélodysplasiques.
Avant chaque division cellulaire, c'est à la machinerie de réplication de l'ADN qu’incombe la tâche immense de copier intégralement et fidèlement la molécule d'ADN, de sorte que l'information génétique soit transmise à la descendance. Cet exploit moléculaire est réalisé en dépit d'une multitude d'obstacles qui entravent la progression de la machinerie de réplication. Ces obstacles peuvent prendre la forme d'une variété d'altérations chimiques de l'ADN induites par les produits du métabolisme ou des facteurs environnementaux tels que les radiations UV, des structures non-conventionnelles de l'ADN ou des protéines fortement liées à l'ADN. C'est ainsi que tous les organismes vivants ont évolué avec un réseau d'activités biochimiques permettant aux cellules de réparer les lésions de l'ADN et de surmonter les obstacles dus à la duplication de leur génome.
Des mutations des gènes de réparation de l'ADN sont à l'origine de nombreuses maladies héréditaires prédisposant les patients à développer des tumeurs. L'anémie de Fanconi en est une. Les patients AF développent rapidement un syndrome myélodysplasique qui peut évoluer vers une leucémie myéloïde aigüe, et présentent une forte disposition à développer des tumeurs solides. Les patients AF sont hypersensibles aux traitements chimiothérapeutiques conventionnels car les protéines AF sont essentielles à la réparation des pontages inter caténaires induits par ces agents.
D'autre part, des données récentes suggèrent que les protéines de l'AF atténuent les conflits entre les machineries de transcription et de réplication qui progressent sur la même matrice d'ADN. La mauvaise coordination entre la transcription, les processus co-transcriptionnels et la réplication de l'ADN représente une source importante d'instabilité génétique associé au processus de cancérogenèse. Les protéines FANCI et FANCD2 occupent une position clé dans le réseau des protéines de l'AF.
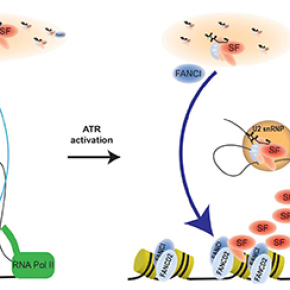
Afin de mieux comprendre la fonction de FANCI, les chercheuses ont analysé le protéome associé à la protéine FANCI sur la chromatine. Contre toute attente, elles ont découvert que la protéine la plus abondante dans l'environnement proche de FANCI est SF3B1. Cette protéine est un membre de la particule d’épissage appelée « spliceosome » et plus particulièrement de la particule U2 snRNP. SF3B1 permet à l’U2 snRNP de s'associer correctement à son point de branchement et d'orienter ainsi le site d'épissage. SF3B1 stockée dans le nucléoplasme dans des structures appelées "nuclear speckles", s'associe sur la chromatine aux nucléosomes localisés au niveau des exons à épisser, et est engagée dans l'épissage co-transcriptionnel des brins naissants. Les analyses ont révélé que FANCD2 et FANCI régulent la distribution de SF3B1 à travers ces différents sites dans le noyau, notamment en réponse à l'exposition des cellules à des inhibiteurs de la réplication.
Cette étude apporte de nouveaux éléments suggérant que FANCI et FANCD2 contribuent à déterminer le répertoire transcriptionnel des cellules. Elle met en évidence une interface biochimique qui offre un point de départ pour explorer les mécanismes de coordination de la transcription et de la réplication nécessaires au maintien de l'intégrité du génome. De plus, le gène SF3B1 est fréquemment muté chez des malades atteints de myélodysplasie. L'association de SF3B1 avec des protéines de l'AF offre de nouvelles perspectives pour comprendre les bases moléculaires des syndromes myélodysplasiques.
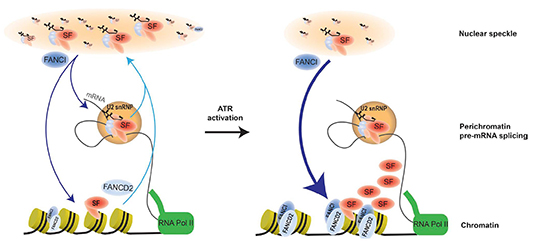
© Moriel-Carretero et al.
En savoir plus
-
Fanconi anemia FANCD2 and FANCI proteins regulate the nuclear dynamics of splicing factors.
Moriel-Carretero M, Ovejero S, Gérus-Durand M, Vryzas D, Constantinou A.
J Cell Biol. 2017 Oct 13. pii: jcb.201702136. doi: 10.1083/jcb.201702136.