Une nouvelle méthode pour suivre de près la transmission des gènes chez les bactéries
La conjugaison est un mécanisme de transfert génétique horizontal entre bactéries donneuses et receveuses, responsable, entre autres, de la dissémination des résistances aux antibiotiques. Dans un article publié dans Nucleic Acids Research, des scientifiques ont mis au point une technique qui, permet d’éliminer sélectivement les cellules donneuses pour analyser précisément les plasmides après conjugaison. Cet outil inédit révèle comment certains gènes sont activés dès l’arrivée de l’ADN transféré et ouvre la voie à une compréhension fine des mécanismes d’établissement des plasmides.
La conjugaison bactérienne : un moteur de l’évolution…et de la résistance aux antibiotiques
La conjugaison bactérienne est un mode de transfert génétique horizontal où une bactérie donneuse transmet de l’ADN à une bactérie receveuse. Dans la nature, ce processus contribue fortement à l’évolution des génomes bactériens et à la diffusion de caractéristiques majeures : virulence, symbiose, résistance aux antibiotiques ou aux métaux lourds. Cette dissémination, en particulier de plasmides multirésistants, représente l’une des menaces les plus sérieuses pour la santé publique mondiale. La conjugaison est également un outil clé en génétique bactérienne en laboratoire.
Pourtant, malgré des décennies d’études, certains aspects moléculaires restent mal compris. En effet, les plasmides sont maintenus sous forme d'ADN double brin circulaire alors que ce qui est transféré lors de la conjugaison est un ADN simple brin linéaire. La manière dont la cellule receveuse reconstitue un plasmide complet, ainsi que la régulation précise de l'expression des gènes plasmidiques face aux défenses de l’hôte (comme le système CRISPR), demeurent peu élucidés.
ED-TA : une méthode innovante pour étudier finement les plasmides après conjugaison
Étudier les mécanismes actifs dans les cellules receveuses nécessitait jusqu’ici de séparer physiquement donneurs et receveurs avant d’extraire ADN ou ARN, pour éviter la contamination par le matériel génétique des donneurs. Cette étape de tri, longue et exigeant des équipements spécialisés, était un frein majeur.
Dans une étude, publiée dans la revue Nucleic Acids Research, des scientifiques ont développé une méthode, appelée ED-TA (Elimination of Donor population for Transconjugant Analysis). En utilisant un mutant particulier d’Escherichia coli, ils parviennent à éliminer rapidement et efficacement les cellules donneuses, supprimant ainsi la nécessité du tri préalable.
Grâce à la méthode ED-TA, ils ont pu établir le profil de transcription d’un plasmide cliniquement important, impliqué dans la résistance aux antibiotiques. Leur analyse montre que les promoteurs spécifiques à l’ADN simple brin permettent une induction robuste d'un sous-ensemble de gènes dès les premiers stades de la conjugaison. De plus, ils ont utilisé cette nouvelle approche pour mieux comprendre les raisons pour lesquelles certaines conjugaisons échouent : jusqu’ici, les connaissances sur la conjugaison abortive se limitaient essentiellement au constat qu’elle « ne forme pas de colonies ». La méthode ED-TA permet désormais d’apporter la preuve des mécanismes responsables de ces échecs.
Cette méthode simple et largement applicable ouvre désormais la voie à l’exploration détaillée des étapes moléculaires qui permettent à un plasmide de s’établir dans une nouvelle cellule après son transfert.
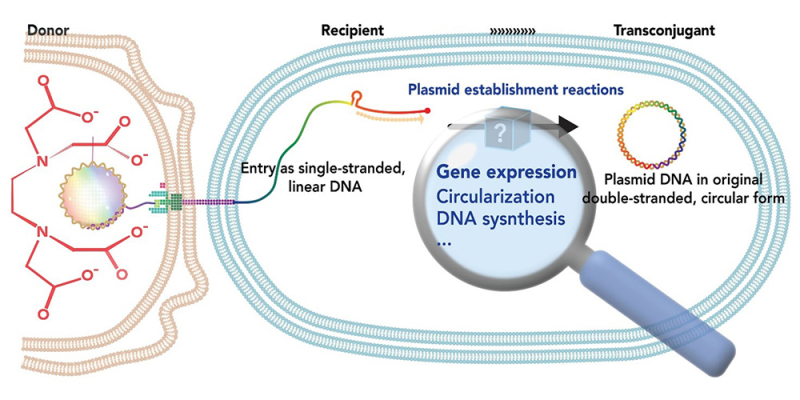
Figure : Une nouvelle méthode ED-TA a permis l'étude génomique de l'établissement des plasmides. La méthode ED-TA exploite une souche mutante d'E. coli appelée DISCO, dont la membrane externe et le peptidoglycane sont « disconnected » (dissociés), comme donneur. Ce mutant est hypersensible au choc hypoosmotique et est éliminé très rapidement et efficacement par une solution d'EDTA, un réactif commun au laboratoire (à gauche). La suppression de la sous-population du mélange de conjugaison permet de se concentrer sur les réactions se passant dans la cellule receveuse pour l'établissement du plasmide, telles que l'expression génétique, la circularisation, la synthèse du second brin d'ADN, etc. (à droite).
En savoir plus : Meng Wen, Nathan Fraikin, Emma Mettouchi, Christian Lesterlin, Elena Espinosa, Yoshiharu Yamaichi, Selective elimination of donor bacteria enables global profiling of plasmid gene expression at early stages of conjugation, Nucleic Acids Research, Volume 53, Issue 22, 11 December 2025, gkaf1299, https://doi.org/10.1093/nar/gkaf1299
Contact
Laboratoire
Institut de biologie intégrative de la cellule - I2BC (CEA/CNRS/Université Paris-Saclay)
Avenue de la Terrasse
91198 Gif-sur-Yvette
