Nouvel éclairage sur les causes de l’inflammation dans le syndrome de Rett
Dans une étude publiée dans Nature Communications, des scientifiques montrent que la protéine MeCP2, connue pour réguler l’expression des gènes dans le noyau, se révèle aussi un acteur clé du contrôle de l’inflammation. Cette protéine est mutée chez les patients atteints d’une maladie neurodéveloppementale rare, le syndrome de Rett. En mettant en évidence un nouveau rôle de MeCP2 dans la prévention des réponses inflammatoires excessives, cette étude ouvre des perspectives thérapeutiques nouvelles.
MeCP2, un chef d’orchestre du génome qui peut aussi contrôler les réponses immunitaires
La protéine MeCP2 est surtout connue pour son rôle dans la régulation de l’expression des gènes au sein du noyau des cellules. Elle agit comme un véritable « chef d’orchestre » de la lecture du génome. Des mutations du gène MeCP2 sont responsables du syndrome de Rett, une maladie neurodéveloppementale rare qui touche presque exclusivement les filles et provoque des troubles moteurs, cognitifs et respiratoires. Au-delà de ses fonctions cérébrales, des travaux récents suggèrent que MeCP2 pourrait aussi participer au contrôle des réponses immunitaires sans que les mécanismes soient bien compris.
Dans une étude publiée dans la revue Nature Communications, des scientifiques ont mis en évidence un rôle inattendu de MeCP2 dans la régulation de l’inflammation déclenchée par la présence d’ADN dans le cytoplasme des cellules. Cet ADN peut provenir de virus, de dommages cellulaires ou encore de séquences génétiques internes appelées éléments transposables.
Normalement, cet ADN « étranger » active une voie de défense appelée cGAS-STING, qui déclenche la production d’interférons de type I. Ces molécules antivirales sont utiles sur le court terme mais peuvent devenir nocives si la réponse se prolonge.
En travaillant sur des modèles cellulaires humains et murins, ainsi que des souris déficientes en MeCP2, les scientifiques ont découvert que cette protéine quitte temporairement le noyau lorsqu’un ADN étranger apparaît dans le cytoplasme. Là, elle se fixe sur cet ADN et empêche la protéine cGAS de le détecter, limitant ainsi l’activation de la voie inflammatoire. En revanche, lorsque MeCP2 est absente ou mutée, cGAS détecte plus facilement ces fragments d’ADN, entraînant une production accrue de molécules inflammatoires et un état antiviral permanent.
Un lien entre inflammation chronique et syndrome de Rett
La sortie de MeCP2 du noyau perturbe aussi ses fonctions classiques de régulation des gènes. Cela favorise la réactivation d’éléments transposables, capables de se copier-coller dans le génome. Leur expression excessive génère à nouveau de l’ADN dans le cytoplasme, entretenant un cercle vicieux d’inflammation.
Chez des patients atteints du syndrome de Rett, les scientifiques ont observé des signatures immunitaires caractéristiques d’une activation persistante de la voie cGAS–STING. Ces anomalies pourraient donc contribuer aux troubles immunitaires associés à la maladie.
Ces travaux ouvrent donc une nouvelle perspective : cibler les voies de détection de l’ADN ou réduire l’activité des éléments transposables pour atténuer l’inflammation chronique chez les patients atteints de déficience en MeCP2. Des traitements existants, tels que les inhibiteurs de la transcriptase inverse, déjà utilisés contre le VIH, se révèlent prometteurs dans ce contexte.
Cette étude met en lumière un rôle inédit de MeCP2 comme « frein » naturel de l’immunité innée, reliant la régulation de la transcription à la maîtrise de l’inflammation, une découverte qui pourrait ouvrir la voie à de nouvelles approches thérapeutiques dans le syndrome de Rett et au-delà.
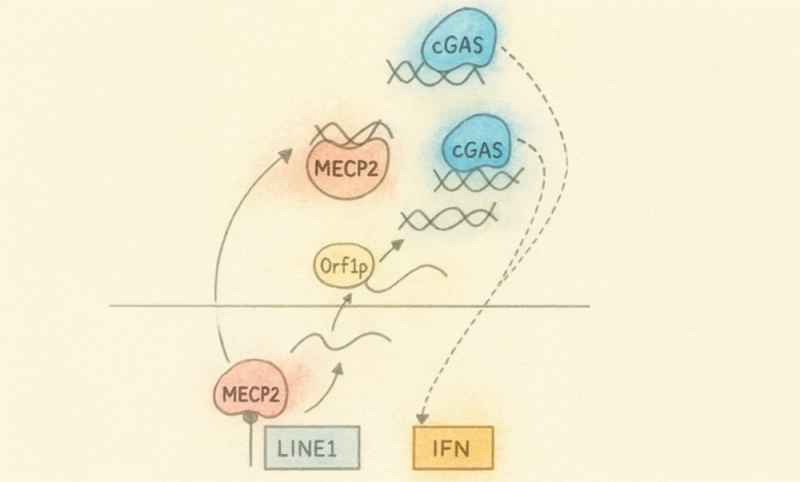
Figure : Mecp2, gardien de l’inflammation. En présence d’ADN double brin dans le cytosol, Mecp2 est déplacé hors du noyau. Cette protéine interagit avec les ADN double brin dans le cytosol, inhibant leur reconnaissance par le récepteur cGAS et atténuant ainsi la réponse inflammatoire qui en découle, notamment caractérisée par une production d’interférons (IFN) de type 1. Le déplacement de MeCP2 va aussi induire une réexpression d’éléments transposables (LINE1) qui vont, via l’action de la protéine Orf1p générer de nouveaux substrats d’ADN susceptibles d’activer les réponses inflammatoires dépendantes de cGAS.
En savoir plus : Chamma H, Guha S, Eloiflin RJ, Augereau A, Le Hars P, Schüssler M, Messaoud-Nacer Y, Salma M, McKellar J, Re J, Chemarin M, Carrier A, Disyak MA, Taffoni C, Charpentier R, Husson Z, Valjent E, Andrieu-Soler C, Soler E, Christensen MH, Paludan SR, Schmidt FI, Tropea D, Majzoub K, Vila IK, Laguette N. The methyl-CpG-binding protein 2 inhibits cGAS-associated signaling. Nat Commun. 2025 Nov 7;16(1):9827. doi: 10.1038/s41467-025-65713-z. PMID: 41203665; PMCID: PMC12595089.
Contact
Laboratoire
Institut de génétique moléculaire de Montpellier - IGMM (CNRS/Université de Montpellier)
CNRS
Campus CNRS/IGMM
1919 Route de Mende
34293 MONTPELLIER CEDEX 5 - France