Quand le plan du corps s’écrit à deux voix : ADN et ARN, une nouvelle partition de la régulation génique
Les facteurs de transcription Hox, longtemps considérés comme des lecteurs d’ADN, s’avèrent aussi interagir directement avec l’ARN. Une étude publiée dans Nucleic Acids Research montre que la protéine Hox Ultrabithorax coordonne l’expression génique et l’épissage de l’ARN via une double capacité de liaison à l’ADN et à l’ARN. Ce mécanisme révèle une nouvelle logique de régulation moléculaire dans la formation du plan du corps et des muscles au cours du développement.
Un facteur Hox à double voix : ADN et ARN en dialogue
Chez tous les animaux, des protéines appelées facteurs de transcription Hox jouent un rôle clé dans la formation du corps pendant le développement embryonnaire. Chez la mouche drosophile, l’un de ces facteurs, nommé Ultrabithorax (Ubx), est bien connu pour sa capacité à se lier à l’ADN et à activer l’expression des gènes responsables de l’identité des différentes parties du corps.
Mais cette vision est aujourd’hui élargie. Ubx peut aussi se lier directement à l’ARN, une molécule intermédiaire entre l’ADN et les protéines. Cette interaction influence un processus appelé épissage alternatif, qui permet de produire plusieurs versions d’une protéine à partir d’un seul gène, adaptant ainsi l’expression génétique aux besoins des tissus ou des étapes du développement.
Ce double rôle est assuré par une même région de la protéine, le domaine homeobox, qui permet à Ubx de lier à la fois l’ADN et l’ARN. Mais cette découverte pose de nouvelles questions : Comment ces deux fonctions s’exercent-elles ? Et quelles sont les conséquences sur le développement de l’organisme ?
La génétique de la drosophile pour relier molécules et fonctions
Pour comprendre la portée biologique de cette double interaction, des scientifiques, dans un article publié dans la revue Nucleic Acids Research, ont mené des expériences moléculaires et de génétique fine chez la drosophile. Ils ont découvert et caractérisé un mutant spécifique d’Ubx incapable de lier l’ARN, mais toujours capable de lier l’ADN. Dans des cellules de drosophile, ils ont montré que ce mutant modifie l’épissage de gènes cibles, avec des effets en partie distincts de ceux observés avec un mutant qui ne se lie pas à l’ADN.
Ce sont les manipulations génétiques in vivo qui révèlent toute l’importance de cette activité. Dans un contexte embryonnaire sensibilisé (mutant) qui montre des défauts musculaires facilement observables, seule la version normale d’Ubx permet de corriger ces anomalies musculaires de l’embryon. En testant différents mutants de liaison à l’ADN ou l’ARN d’Ubx, les scientifiques ont démontré que chaque type d’interaction joue un rôle complémentaire dans la formation du muscle et l’établissement des identités cellulaires embryonnaires.
Mais l’expérience la plus frappante est la suivante : dans des embryons dépourvus de protéine Ubx endogène, les scientifiques ont montré qu’en exprimant simultanément les deux formes mutantes de la protéine Ubx, l’une déficiente pour la liaison à l’ADN, l’autre pour l’ARN, ils pouvaient restaurer complètement la fonction de la protéine d’origine. Ce partage des tâches entre les deux mutants montre que les fonctions ADN et ARN sont non seulement distinctes mais aussi indissociables pour que le développement se déroule normalement. Cette découverte redéfinit les modes d’action des protéines Hox dans le développement.
Vers une nouvelle compréhension du développement et de ses dérèglements
Cette découverte bouleverse notre compréhension du rôle des facteurs Hox. Ils ne sont plus seulement des "lecteurs d’ADN" qui déclenchent l’expression des gènes, mais aussi des acteurs dans la maturation des ARN, une étape clé pour produire des protéines fonctionnelles.
Ce mécanisme découvert chez la drosophile pourrait exister dans d’autres espèces, y compris chez l’humain, car tous les facteurs Hox partagent un domaine homeobox liant l’ADN et l’ARN. Ces travaux ouvrent ainsi la voie à une vision plus intégrée du développement : ADN et ARN ne sont pas traités séparément, mais en coordination, pour façonner les tissus et les organes.
Au-delà du développement, cette découverte pourrait aider à mieux comprendre des maladies liées à des défauts d’épissage, comme certaines myopathies (maladies musculaires). Elle souligne aussi l’importance de la recherche fondamentale sur des organismes modèles comme la drosophile, qui permettent d’explorer en détail les rouages invisibles du vivant.
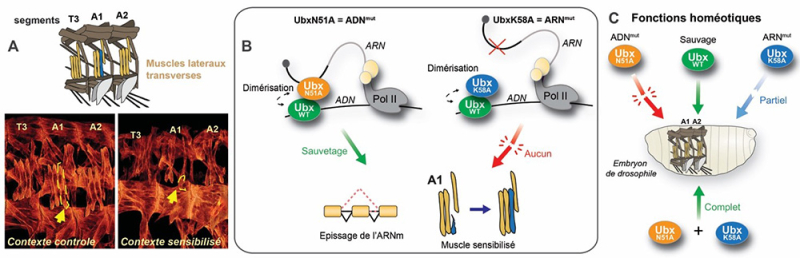
Figure : Ultrabithorax agit via une double interaction ADN et ARN pour réguler la formation des muscles et l’identité des territoires embryonnaires. A. Représentation schématique des muscles latéraux transverses (en jaune et bleu) dans les segments T3, A1 et A2 chez l’embryon de drosophile. Images de microscopie confocale des muscles embryonnaires en situation contrôle (à gauche, Ubx hétérozygote) ou en contexte sensibilisé (à droite, interaction génétique entre Ubx et le facteur d’épissage snRNPU1-70K), mettant en évidence une altération musculaire spécifique dans le segment A1. B. Schéma du mécanisme d’action d’Ubx. À gauche : Ubx sauvage (vert) et un mutant déficient pour l’ADN (UbxN51A, orange) peuvent former un dimère, se lier à l’ARN et assurer la régulation correcte de l’épissage et la formation musculaire. À droite : un mutant incapable de lier l’ARN (UbxK58A, bleu) ne peut compenser la perte d’Ubx, entraînant une altération musculaire. C. Effets des différentes formes d’Ubx sur les fonctions homéotiques. Le mutant ADN seul (UbxN51A) ou ARN seul (UbxK58A) ne permet qu’un sauvetage partiel ou nul. Mais leur co-expression dans des embryons dépourvus d’Ubx endogène permet un sauvetage complet du développement musculaire, démontrant le rôle essentiel et complémentaire de la double interaction ADN/ARN.
Pour en savoir plus : Blanco C, Xiang W, Boumpas P, Buvry E, Scorcelletti M, Hermon AS, Wong J, Merabet S, Carnesecchi J. Synergistic DNA and RNA binding of the Hox transcription factor Ultrabithorax coordinates splicing and shapes in vivo homeotic functions. Nucleic Acids Res. 2025 Jun 20;53(12):gkaf602. doi: 10.1093/nar/gkaf602. PMID: 40613713; PMCID: PMC12231573.
Contact
Laboratoire
Institut de génétique moléculaire de Montpellier - IGMM (CNRS/Université de Montpellier)
CNRS
Campus CNRS/IGMM
1919 Route de Mende
34293 MONTPELLIER CEDEX 5 - France