Un rôle inattendu des cils primaires dans le développement neural humain
Le cil primaire est une antenne par laquelle la cellule capte des signaux chimiques ou physiques de son environnement. Dans une étude publiée dans Nature Communications, des scientifiques ont utilisé des organoïdes de moelle épinière dérivés de cellules souches humaines et murines, portant des mutations liées à des maladies génétiques appelées ciliopathies. Leurs travaux apportent un nouvel éclairage sur le rôle des cils primaires dans le développement neural humain.
Les cils primaires : des antennes cellulaires essentielles
Les cils primaires, présents sur la quasi-totalité des cellules, agissent comme des antennes cellulaires qui reçoivent des signaux chimiques et physiques de l’environnement, assurant un développement et un fonctionnement normal des organes. Chez l’homme, des défauts de formation et de fonction des cils sont la cause d’un ensemble de maladies rares appelées collectivement les « ciliopathies », qui affectent de nombreux organes, en particulier le cerveau.
Des organoïdes pour mieux comprendre les ciliopathies
Malgré l’apport essentiel des études sur des organismes modèles, comme la souris, le développement du cerveau humain reste mal connu et nécessite de nouvelles approches. Afin d’aborder le rôle des cils et des gènes responsables des ciliopathies chez l’homme, les scientifiques ont choisi une approche de production d’organoïdes, des assemblages cellulaires en 3 dimensions obtenus à partir de cellules souches pluripotentes humaines. Mises en présence de plusieurs facteurs dans un milieu approprié, les cellules souches s'auto-organisent pendant plusieurs semaines pour former un « organoïde », imitant ainsi certaines étapes du développement de l’organe en question de manière simplifiée. Les chercheurs analysent ensuite l’intégrité des cils primaires et le développement neuronal sur ces organoïdes par des analyses génétiques et cellulaires.
Des différences notables entre organoïdes murins et humains
Dans ce travail, publié dans la revue Nature Communications, les scientifiques ont dérivé des cellules souches pluripotentes mutantes pour deux gènes RPGRIP1L et TMEM67, dont les mutations sont à l'origine de ciliopathies neurodéveloppementales sévères. Ces deux gènes codent pour des protéines de la zone de transition, une région à la base du cil essentielle à la stabilité des cils primaires. Les cellules ont été différenciées en neurones moteurs de la moelle épinière.
Cette approche a permis de faire trois découvertes :
- Différences Homme-Souris : Contrairement à la souris, les protéines étudiées ne sont pas nécessaires à la formation des neurones moteurs dans les organoïdes humains. En effet, les cellules des organoïdes différenciées en neurones moteurs ont des cils primaires, contrairement aux cellules murines qui perdent les cils lorsqu’elles sont mutées pour ces deux protéines. Bien que ces cils primaires aient un contenu protéique altéré, ils sont parfaitement capables de transduire la voie de signalisation Sonic Hedgehog (SHH) pour fabriquer des neurones moteurs.
- Identité altérée des neurones moteurs : Les neurones moteurs des organoïdes déficients en RPGRIP1L, mais pas en TMEM67, présentent une identité antéro-postérieure altérée, acquérant au cours de leur formation une identité de cerveau postérieur ou de moelle épinière « cervicale », aux dépens de l’identité « moelle épinière thoracique » observée dans les organoïdes obtenus à partir de cellules sans mutation. L’analyse de l’expression des gènes montre que la mutation provoque une altération de l’expression des gènes HOX, des gènes qui définissent l’identité antéropostérieure des neurones sur l’axe du corps.
- Implication des progéniteurs axiaux : Enfin, les scientifiques ont recherché l'origine de ce phénotype en remontant jusqu'aux premières cellules à l’origine de la moelle épinière, appelées progéniteurs axiaux. Les progéniteurs axiaux déficients en RPGRIP1L, mais pas en TMEM67, sont dépourvus de cils et présentent une identité altérée. Cela démontre le rôle spécifique, selon le type cellulaire et le stade de développement, d'une protéine de la zone de transition ciliaire dans la stabilité et la fonction des cils au cours de la construction du système nerveux central.
Ces travaux révèlent une spécificité, selon le type cellulaire et l'espèce, de la stabilité des cils au cours du développement du système nerveux. Ils mettent également en lumière un rôle inattendu des cils dans les progéniteurs axiaux et donc dans l'élongation et la spécification de l’axe du corps. Ces résultats ouvrent de nouvelles perspectives de recherche sur l'origine des ciliopathies affectant le développement du système nerveux.
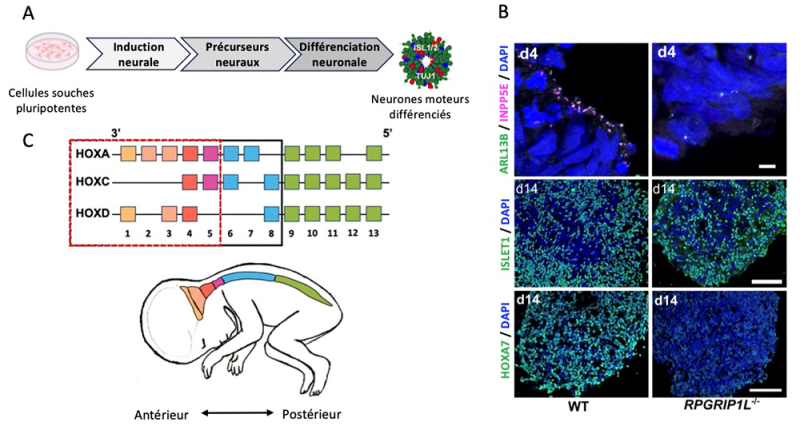
Figure :
- A) Schéma de la différenciation des cellules souches pluripotentes en organoïdes spinaux.
- B) Immunomarquages d’organoïdes spinaux. Haut : présence des cils (marqués par ARL13B et INPP5E) dans les progéniteurs axiaux WT et leur absence dans les progéniteurs RPGRIP1L-KO. Milieu : présence des neurones moteurs différenciés (marqués par ISLET1) dans les organoïdes spinaux WT et RPGRIP1L-KO. Bas: expression différentielle de la protéine HOXA7 dans les neurones moteurs WT et RPGRIP1L-KO. Le marquage DAPI indique le noyau des cellules. D4/D14 : jour 4/jour 14 de la différenciation. Barre d’échelle : haut 5 microns ; milieu et bas 500 microns.
- C) Schéma montrant le code d’expression des gènes HOX le long de l’axe antéro-postérieur du système nerveux central. Les rectangles en trait plein noir et pointillés rouges indiquent respectivement les gènes HOX exprimés dans les précurseurs de motoneurones WT et RPGRIP1L-KO.
En savoir plus : Wiegering A, Anselme I, Brunetti L, Metayer-Derout L, Calderon D, Thomas S, Nedelec S, Eschstruth A, Serpieri V, Catala M, Antoniewski C, Schneider-Maunoury S, Stedman A. A differential requirement for ciliary transition zone proteins in human and mouse neural progenitor fate specification. Nat Commun. 2025 Apr 5;16(1):3258. doi: 10.1038/s41467-025-58554-3. PMID: 40188187; PMCID: PMC11972330.
Contact
Laboratoire
Développement, adaptation, vieillissement/Institut biologie Paris Seine - IBPS (CNRS/Inserm/Sorbonne Université)
7-9 quai Saint Bernard
75005 Paris