Dérégulation de la protéine TRIO à l’origine de troubles du neurodéveloppement
Les mutations dans le gène TRIO sont associées à l’autisme et la déficience intellectuelle. Dans une étude publiée dans la revue Molecular Psychiatry, les scientifiques ont mis en évidence un mécanisme par lequel l’auto-inhibition de la protéine TRIO est essentielle à un développement neuronal correct. Les mutations pathogènes lèvent cette inhibition et perturbent le guidage axonal des motoneurones chez le poisson zèbre. Ces recherches ouvrent la voie à une meilleure prise en charge des patients et de nouvelles stratégies thérapeutiques pour ces maladies neurodéveloppementales.
Les troubles du neurodéveloppement (TND) tels que l’autisme et la déficience intellectuelle sont des maladies complexes et hétérogènes qui représentent un réel problème de santé publique. Bien que les causes de ces maladies soient diverses, elles incluent une forte composante génétique. Les progrès du séquençage à haut débit ont permis d’identifier récemment des mutations dans un certain nombre de gènes chez des patients souffrant de ces troubles.
Parmi ces gènes, le gène TRIO est maintenant considéré comme gène à risque pour ces pathologies. La protéine TRIO joue un rôle majeur dans le développement neuronal en contrôlant le remodelage du cytosquelette d'actine, principalement en activant la protéine RAC1.
Les scientifiques avaient précédemment établi la première corrélation phénotype/génotype dans les maladies associées à TRIO, avec une corrélation frappante entre le tableau clinique des individus et la modulation opposée de l'activité de RAC1 par les variants de TRIO ciblant différents domaines du gène. Les mutations hyperactivant RAC1 sont particulièrement intéressantes, car elles sont retrouvées de manière récurrente chez les patients et sont associées à une forme sévère de TND et à une macrocéphalie, indiquant leur importance dans l'étiologie de la maladie. Pourtant, on ignore encore comment ces variants pathogènes de TRIO perturbent l'activité de TRIO au niveau moléculaire et comment ils affectent les processus neurodéveloppementaux fondamentaux, tels que la croissance ou le guidage des axones.
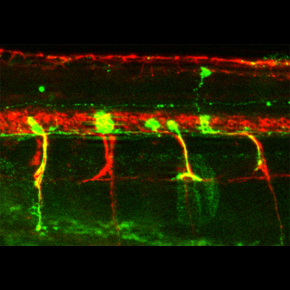
Dans cette nouvelle étude, les scientifiques rapportent une cohorte supplémentaire d'individus porteurs d'un variant pathogène de TRIO, renforçant ainsi leur corrélation phénotype/génotype initiale. Plus important encore, ces travaux de prédictions de conformation, couplés à une validation biochimique, permettent de proposer que la protéine TRIO est auto-inhibée par un repli intramoléculaire et que les variants associés aux TND lèvent cette inhibition, conduisant à une hyperactivation de RAC1. De plus, dans des neurones primaires en culture et dans le modèle de développement du poisson zèbre, ils montrent que les variants à gain-de-fonction affectent de manière différentielle la croissance et la ramification des axones in vitro et in vivo, par rapport aux variants TRIO à perte-de-fonction.
En combinant des données cliniques, moléculaires, cellulaires et in vivo, les scientifiques apportent donc de nouvelles preuves convaincantes de la pathogénicité de nouveaux variants génétiques ciblant le gène TRIO dans les TND. Ils mettent en lumière un nouveau mécanisme par lequel la régulation fine de l'activité de TRIO par repliement intramoléculaire est essentielle au bon développement neuronal et que celle-ci est perturbée par des mutations pathogènes présentes chez les patients souffrant d’autisme et de déficience intellectuelle.
La compréhension de ces mécanismes de pathogénicité des variants TRIO est essentielle pour une meilleure prise en charge des patients atteints de maladies neurodéveloppementales.
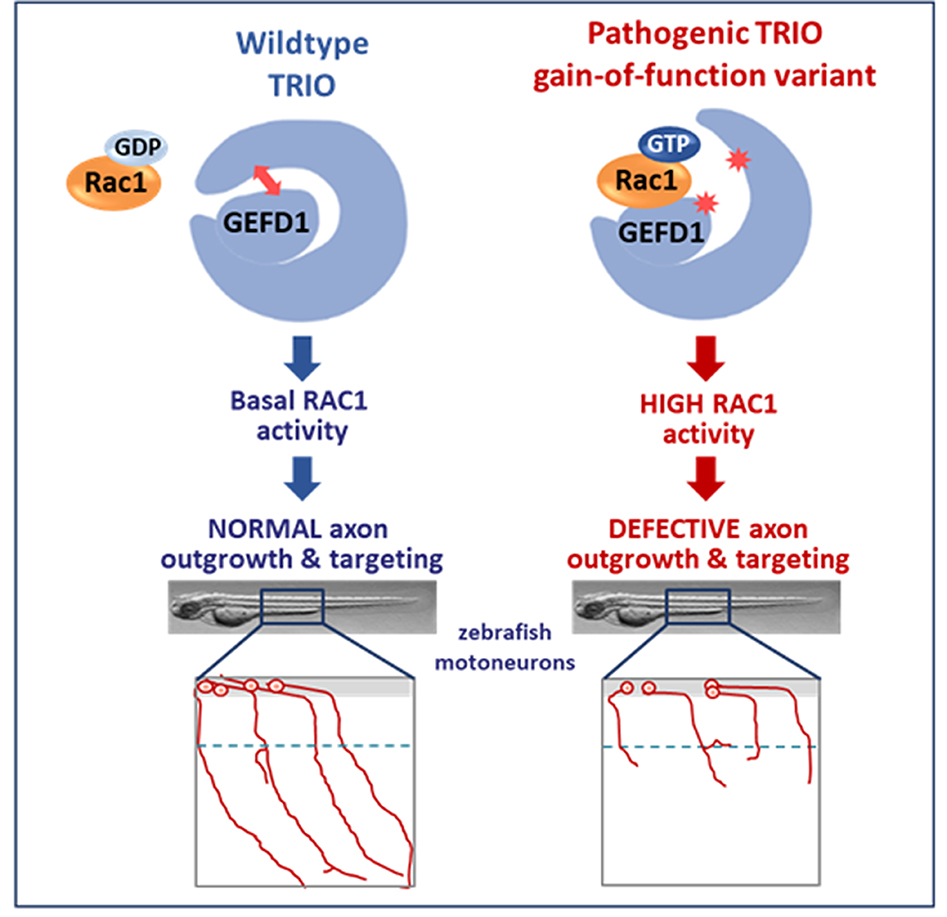
Figure : Modèle du mécanisme par lequel les mutations pathogènes de TRIO lèvent l'auto-inhibition de la protéine et perturbent le développement neuronal.
Pour en savoir plus :
Pathogenic TRIO variants associated with neurodevelopmental disorders perturb the molecular regulation of TRIO and axon pathfinding in vivo.
Maxime Bonnet, Fiona Roche, Christine Fagotto-Kaufmann, Gabriella Gazdagh, Iona Truong, Franck Comunale, Sonia Barbosa, Marion Bonhomme, Nicolas Nafati, David Hunt, Monserrat Pons Rodriguez, Ayeshah Chaudhry, Deborah Shears, Marcos Madruga, Fleur Vansenne, Aurore Curie, Andrey V. Kajava, Diana Baralle, Coralie Fassier, Anne Debant & Susanne Schmidt
Molecular Psychiatry, 2023, jan 30. DOI: https://doi.org/10.1038/s41380-023-01963-x
Contact
Laboratoire
Centre de recherche en biologie cellulaire de Montpellier (CNRS/Université de Montpellier)
1919 Route de Mende
34293 Montpellier