Des plateformes d’efflux de métaux dans la membrane des bactéries
Les scientifiques ont découvert chez le pathogène Mycobacterium tuberculosis, l’agent de la tuberculose, un mécanisme inédit de résistance à l’intoxication métallique dans les macrophages mettant en jeu des plateformes mobiles dans la membrane plasmique de la bactérie. Ces plateformes sont constituées de pompes d’efflux de métaux de la famille des « ATPases de type P », ainsi que d’une classe entièrement nouvelle, les protéines « PacL ». Des homologues des protéines PacL sont présents chez de nombreuses bactéries, et la présence de plateformes d’efflux des métaux toxiques est sans doute très répandue chez les procaryotes. Ces résultats, qui éclairent la métallobiologie des bactéries, sont publiés dans la revue Nature Communications.
Les bactéries, qu’elles soient environnementales, commensales, symbiotiques, opportunistes ou pathogènes, doivent sans cesse s’adapter à leur environnement dont les conditions fluctuent en permanence. Ainsi quand les bactéries pathogènes infectent leurs hôtes, elles sont phagocytées par les macrophages, cellules immunitaires sentinelles qui patrouillent dans tous les tissus et en assurent le nettoyage et ainsi l’équilibre.
Les scientifiques avaient préalablement identifié un mécanisme par lequel les macrophages peuvent éliminer ou contrôler les pathogènes qu’ils ingèrent par phagocytose, en accumulant dans les vacuoles de phagocytose des métaux, en particulier le zinc, à des concentrations potentiellement toxiques pour les bactéries. Ils avaient également démontré le rôle de la pompe d’efflux de métaux CtpC, pompe de la famille des ATPases de type P, dans la résistance du bacille de la tuberculose, Mycobacterium tuberculosis, au stress métallique au sein des macrophages. La protéine CtpC est produite accompagnée d’une petite protéine portant un domaine de fonction inconnu (Domain of unknown function ou DUF1489), appelée Rv3269. Comme CtpC, la protéine Rv3269 se localise dans la membrane plasmique de la bactérie. Par ailleurs, elle porte un motif de liaison des métaux.
Dans la présente étude, les scientifiques montrent que CtpC et Rv3269 sont localisées dans des microdomaines mobiles dans la membrane bactérienne, où Rv3269 peut à la fois lier le zinc et jouer un rôle de chaperon moléculaire en stabilisant la protéine CtpC. Ainsi Rv3269 est renommée PacL1, pour P-ATPase-associated chaperone-Like protein 1. Similairement, les protéines CtpG et CtpV sont renommées PacL2 et PacL3. En l’absence de PacL1, la protéine CtpC est déstabilisée et dégradée et M. tuberculosis devient ultra-sensible au zinc.
Des couples Ctp/PacL sont présent chez de très nombreuses bactéries phylogénétiquement différentes. Cette découverte permet de proposer un modèle entièrement nouveau de résistance au stress métallique chez les bactéries, par l’intermédiaires de plateformes membranaires où s’accumulent à la fois les pompes d’efflux de type Ctp et les petits chaperons moléculaires PacL. Ces résultats ouvrent de nombreuses perspectives non seulement pour combattre les bactéries pathogènes en affaiblissant leur capacité à résister aux stress métalliques au sein de leurs hôtes, mais aussi, plus généralement, pour mieux comprendre la métallobiologie des procaryotes.
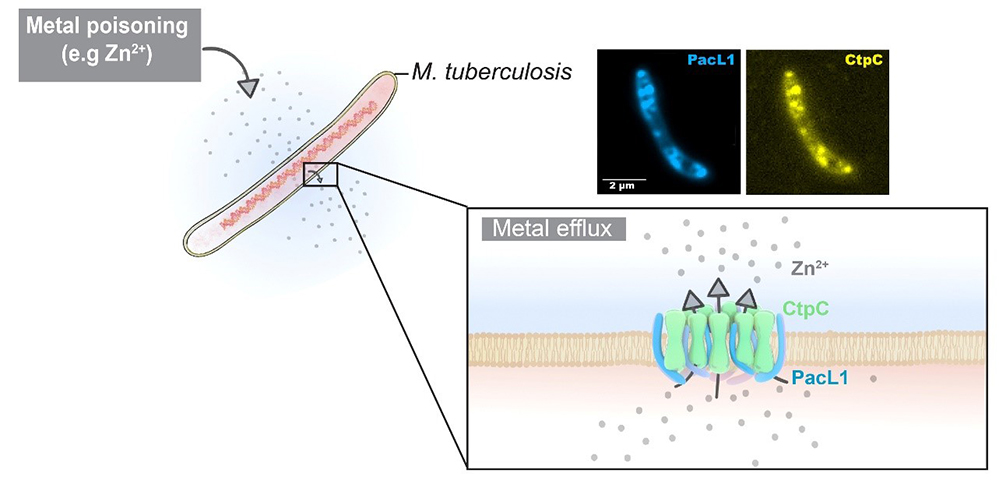
Figure : A l’intérieur des macrophages qu’il parasite le bacille tuberculeux, M. tuberculosis, est soumis à un stress dû à l’accumulation de métaux (ici le zinc) dans la vacuole de phagocytose. Les protéines de la famille PacL (ici PacL1) stabilisent les pompes d’efflux de métaux (ici la pompe CtpC) dans des microdomaines membranaires pour résister à l’intoxication métallique.
Les images de microscopie à fluorescence montrent la co-localisation dans la membrane plasmique de Mycobacterium de la protéine PacL1 (bleu) et de la protéine CtpC (jaune).
Pour en savoir plus :
Mycobacterial resistance to zinc poisoning requires assembly of P-ATPase-containing membrane metal efflux platforms
Yves-Marie Boudehen, Marion Faucher, Xavier Maréchal, Roger Miras, Jérôme Rech, Yoann Rombouts, Olivier Sénèque, Maximilian Wallat, Pascal Demange, Jean-Yves Bouet, Olivier Saurel, Patrice Catty, Claude Gutierrez, Olivier Neyrolles
Nat Commun. 12 aout 2022 . https://doi.org/10.1038/s41467-022-32085-7
Contact
laboratoire
Institut de pharmacologie et de biologie structurale (CNRS, Université de Toulouse)
205 route de Narbonne
31400 Toulouse