Contrôle de la taille cellulaire par les microtubules
Certaines cellules souches se divisent de façon asymétrique et robuste pour générer deux cellules filles de taille différente. Les remaniements du cytosquelette qui accompagnent la division de ces cellules particulières ne sont pas encore bien compris. Cette étude ,publiée dans la revue Cell Reports, montre la contribution importante de certains microtubules pour maintenir le positionnement asymétrique du site de division et donc la taille des futures cellules filles.
La plupart des tissus sont constitués de cellules différenciées et d’un nombre variable de cellules souches. Ces cellules souches sont essentielles au maintien de l’intégrité des tissus en assurant leur homéostasie et leur réparation en cas de dommages. La division de certaines de certaines de ces cellules souches est caractérisée par un positionnement asymétrique du site de clivage durant le processus de cytokinèse (division lors de la mitose), qui aboutit à la formation de deux cellules filles présentant une différence de taille. Cependant, les mécanismes sous-jacents qui régissent cette asymétrie de taille ne sont pas bien caractérisés. Dans les cellules animales, la détermination de la position du site de clivage ainsi que la contraction du sillon de division sont régulées par le complexe "Centralspindline". Ce complexe est localisé sous la forme de deux populations distinctes. Une première population s’enrichit dès la phase de séparation des chromosomes-fils (anaphase) au niveau du cortex cellulaire, au niveau du futur site de division, et une seconde est recrutée au niveau du fuseau mitotique central, la structure de microtubule présente à partir de l’anaphase entre les deux lots de chromosomes préalablement séparés. Durant les divisions cellulaires symétriques ces deux populations du complexe Centralspindline sont localisées en position équatoriale et cette superposition de signaux complique l’analyse fonctionnelle de chacune de ces deux populations sur le processus de cytokinèse. Malgré cette difficulté, les données publiées suggéraient un rôle majeur du fuseau central et du complexe Centralspindline associé pour la détermination du site de division
Dans cette nouvelle étude réalisée dans des cellules souches neurales de drosophile, les scientifiques montrent que les deux populations du complexe Centralspindline sont spatialement et temporellement séparées. Cela permet de caractériser la contribution de chacune de ces populations sur le positionnement du site de division. Dans ces cellules souches, une première population du complexe Centralspindline est recrutée de manière asymétrique au niveau du futur site de clivage, puis une seconde population apparait au niveau de la zone médiane du fuseau central vers l’équateur de la cellule. Le fuseau central se déplace au cours de la cytokinèse pour s’ajuster à la position asymétrique du sillon de division. En utilisant une combinaison d’approches génétique, de photo-ablation laser, associée à de l’imagerie, les scientifiques montrent qu’une population de microtubules astraux, appelés microtubules périphériques, en contact étroit avec le sillon de division, est essentielle au ciblage et à l’enrichissement du complexe Centralspindline au niveau du site de clivage.
Dans des conditions où le nombre de ces microtubules périphériques est diminué ou lorsque ces microtubules sont absents, le recrutement du complexe Centralspindline au site de clivage est altéré. En conséquence, la signalisation émanant du complexe Centralspindline de la zone médiane du fuseau central devient dominante et conduit à un repositionnement du sillon de division vers l’équateur de la cellule. Ce repositionnement du sillon de division induit une diminution de l’asymétrie de taille entre les futures cellules filles. Ce travail révèle donc le rôle crucial des microtubules astraux périphériques pour le positionnement asymétrique du site de clivage au cours du processus de cytokinèse et illustre la modularité des mécanismes de division en fonction du type cellulaire. Des études supplémentaires devront être réalisées afin de mesurer si ces anomalies de taille des cellules modifient leur capacité à se différentier et à proliférer.
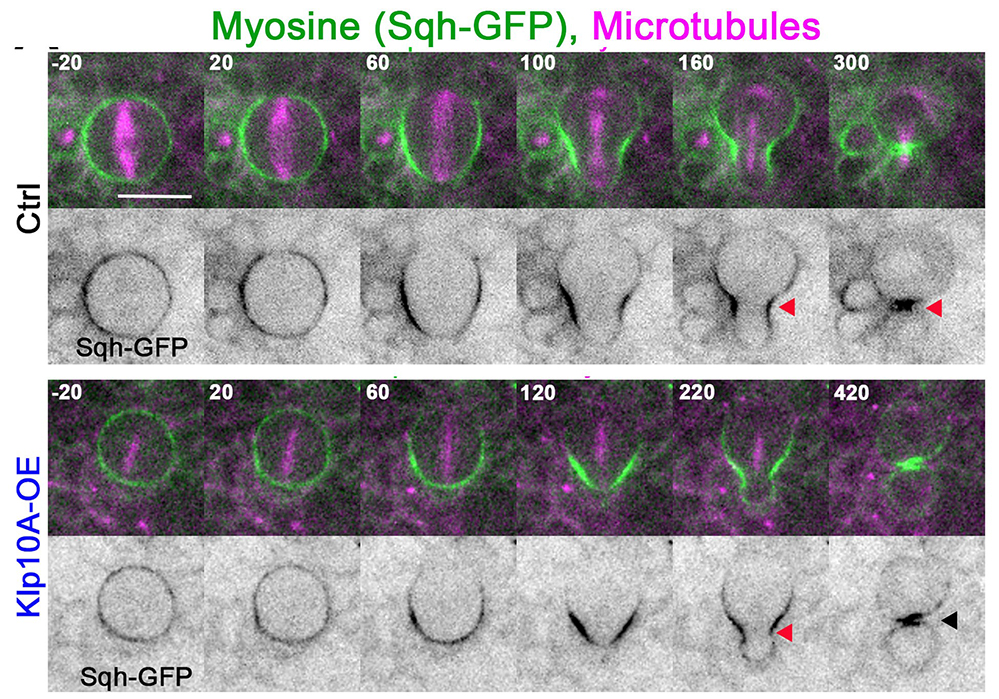
Figure : Analyse dynamique de la position du sillon de division dans une cellule souche neurale de drosophile sauvage (Ctrl) ou surexprimant la protéine déstabilisatrice des microtubules Klp10A (Klp10A-OE). Dans l’image composite la myosine (Sqh-GFP) apparaît en vert (en voir dans les images du bas). Les microtubules sont marqués en violet. Le temps est indiqué en seconde sur chaque image. La barre d’échelle indique 10 microns. La cellule souche sauvage positionne son sillon de division du côté basal (triangles rouges) et se divise de manière asymétrique. La cellule « Klp10A-OE » dont les microtubule astraux sont déstabilisés montre un glissement du sillon initialement positionné du côté basal (triangle rouge) vers l’équateur de la cellule (triangle noir) pour générer deux cellules de taille plus symétriques.
Pour en savoir plus :
Peripheral astral microtubules ensure asymmetric furrow positioning in neural stem cells
Alexandre Thomas, Emmanuel Gallaud, Aude Pascal, Laurence Serre, Isabelle Arnal, Laurent Richard-Parpaillon, Matthew Scott Savoian and Régis Giet.
Cell Reports. 26 octobre 2021. https://doi.org/10.1016/j.celrep.2021.109895
Contact
laboratoire
Institut de Génétique et Développement de Rennes (CNRS/Univeristé de Rennes)
2, Avenue du Pr Léon Bernard
35043 Rennes Cedex