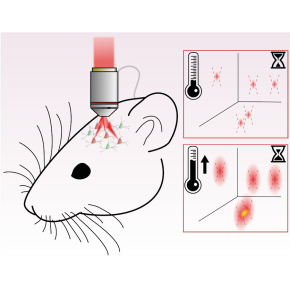
Calcul et mesure de l’échauffement par optogénétique bi-photonique
Les chercheurs ont réalisé une étude numérique et expérimentale de l’échauffement induit lors de l’activation de neurones à l’aide de techniques d’optogénétique. Cette étude repose sur une simulation, validée expérimentalement, de la diffusion de la chaleur produite par l’absorption de la lumière, après propagation et diffusion dans les tissus biologiques. L’étude, fruit d'un travail interdisciplinaire combinant des compétences en optique, physique, chimie biologie et neurophysiologie, a été publiée dans la revue Cell Reports.
Depuis maintenant une quinzaine d’années, une nouvelle approche, l’optogénétique, permet la manipulation optique de l’activité neuronale à l’aide de protéines photosensibles exogènes appelées opsines, naturellement présentes dans certaines algues photosensibles, dont l’expression est induite viralement au sein de l’animal étudié. Ce pan de la recherche, l’optogénétique, a permis de grands progrès dans le domaine des neurosciences, ouvrant des perspectives incroyables dans le domaine de la recherche fondamentale et médicale.
Aujourd’hui, la combinaison de l’optogénétique à l’illumination bi-photonique permet d’obtenir le contrôle de l’activité neuronale en profondeur à l’échelle de la cellule unique avec une résolution temporelle de la milliseconde. Le futur de l’optogénétique est donc de pouvoir manipuler avec ce degré de précision des dizaines, centaines, voire milliers de cellules à la fois avec l’objectif de pouvoir, par exemple, éclaircir le rôle que l’activation spécifique d’un « microcircuit » de neurones a dans le contrôle du comportement. Cependant, la multiplication des cibles entraine inévitablement une augmentation significative de la puissance lumineuse envoyée dans le cerveau et, par conséquent, la probabilité de dégâts photo-induits. Parmi ceux-ci se trouve la possibilité d’un échauffement du tissu cérébral étudié dont les effets peuvent aller de la simple modification physiologique à l’apoptose.
Deux stratégies d’illumination ont émergé pour l’activation optogénétique par excitation bi photonique : l’approche par balayage et l’approche parallèle. La première consiste à déplacer un faisceau lumineux sur la surface de la cellule, de façon à activer séquentiellement les opsines sur le trajet du laser. La seconde repose sur des méthodes de mise en forme des faisceaux, telle que la technique de « computer generated holography », afin d’activer parallèlement tous les canaux ioniques de la surface d’un seul ou de plusieurs neurones.
Afin de pouvoir évaluer l’échauffement local induit dans les deux approches et d’en évaluer les risques, les chercheurs ont développé et validé un modèle optique et thermique décrivant à la fois la propagation de la lumière au sein d’un tissu diffusant comme le cerveau, et la diffusion de la chaleur photo-induite au sein de celui-ci. Ils ont validé expérimentalement ce modèle en utilisant des particules de verre dopés aux terres rares (Er, Yb) (développés par l’équipe de Michel Mortier), possédant un spectre de luminescence dépendant de la température. Ainsi, il a été possible de mesurer une température en excellent accord avec les prévisions du modèle, avec une résolution temporelle de l’ordre de la milliseconde et la précision spatiale du micromètre.
Ce modèle a ensuite été utilisé pour calculer les variations de température lors d’une activation parallèle de neurones de souris in vivo exprimant l’opsine CoChR. Il a ainsi été montré que l’activation d’une cellule provoque une augmentation de la température de seulement quelques dixièmes de Kelvin. Ensuite, les chercheurs ont simulé l’échauffement créé lors de la stimulation parallèle de 100 neurones, dans un volume de 300x300x300 µm et à l’aide de leur modèle ils ont montré les conditions (durée d’illumination, distance entre les spots) qui permettent de minimiser les échauffements induits par l’optogénétique en dessous du Kelvin aussi dans le cas de l’activation de plusieurs cellules.
Enfin, une comparaison des échauffements induits par les deux stratégies d’illumination (parallèle ou à balayage) a été effectuée sur des tranches de cerveau de souris, présentant les avantages et défauts inhérents à chacune. Comme attendu, une augmentation homogène de la température au sein de la cellule est obtenue dans le cas de la stimulation parallèle, tandis que le balayage induit un échauffement sensible au centre du faisceau balayé mais une élévation de température modérée dans les zones non illuminées de la cellule.
Grâce à ces travaux, les différentes équipes travaillant dans le domaine de l’optogénétique pourront optimiser leurs différents protocoles expérimentaux, afin de garantir un environnement contrôlé et sûr aux cellules vivantes étudiées. A cette fin, un jeu de fonctions MATLAB a été mis à la disposition de la communauté scientifique permettant à chacun de modéliser des conditions expérimentales spécifiques. Au-delà de cette application, ce modèle optique et thermique des tissus vivants pourra permettre d’optimiser des stratégies d’échauffement (hyperthermie thérapeutique), d’étudier plus en détails la sensibilité des tissus cérébraux à la chaleur, ou d’améliorer les techniques de thermo génétique.

© Alexis Picot
Pour en savoir plus :
Temperature Rise under Two-Photon Optogenetic Brain Stimulation.
Picot A, Dominguez S, Liu C, Chen IW, Tanese D, Ronzitti E, Berto P, Papagiakoumou E, Oron D, Tessier G, Forget BC, Emiliani V.
Cell Rep. 2018 Jul 31;24(5):1243-1253.e5. doi: 10.1016/j.celrep.2018.06.119.