Un lien entre cils, ciliopathies et malformations du cerveau antérieur
Les cils primaires des cellules reçoivent et interprètent des signaux extracellulaires et leur dysfonctionnement chez l’homme entraîne des maladies graves appelées ciliopathies. Dans un article publié dans Journal of Neuroscience, les chercheurs mettent en lumière le rôle complexe des cils primaires du cerveau antérieur embryonnaire dans la modulation de la voie de signalisation Hedgehog. Ce travail appelle un examen approfondi des liens entre cils, ciliopathies et malformations du cerveau antérieur chez l’homme.
Le rôle des cils dits primaires, qui possèdent une fonction sensorielle, au cours du développement du cerveau est peu connu. Pourtant, des dysfonctionnements des cils entraînent des maladies héréditaires souvent très graves appelées ciliopathies, qui sont parfois caractérisées par des malformations cérébrales sévères. On sait que les cils primaires agissent comme de véritables antennes de la cellule, recevant des signaux extracellulaires et les transmettant à la cellule à travers différentes voies de signalisation. C’est le cas par exemple des voies de signalisation Hedgehog (Hh) et Wnt. Le gène Shh, qui code le principal ligand de la voie Hh chez les mammifères, est un gène majeur de l’holoprosencéphalie, une maladie humaine très sévère caractérisée par des malformations du cerveau et de la face.
Les chercheurs ont étudié le rôle du gène RPGRIP1L, connu pour être associé à des ciliopathies humaines, dans le développement du cerveau antérieur chez la souris en utilisant des animaux dans lesquels ce gène a été inactivé. Leurs résultats montrent que la mutation du gène Rpgrip1l chez la souris entraîne de graves défauts dans le développement du fœtus en fin de gestation : absence complète des deux yeux (anophtalmie), réduction du cerveau antérieur ventral et désorganisation des noyaux diencéphaliques et des axones associés. Les cils primaires du cerveau de ces mutants sont absents ou mal formés.
Au niveau moléculaire, la voie Hedgehog est affectée, alors qu’une autre voie de signalisation importante au cours du développement du cerveau, la voie Wnt-βcaténine, ne l’est pas. De plus, la voie Hh est affectée de manière différente en fonction de la région du cerveau antérieur considérée. Elle est réprimée dans le cerveau antérieur ventral et le thalamus rostral (Figure, A, B, B’). En revanche, pour la formation des yeux, la voie parait trop active chez le mutant Rpgrip1l puisque la perte des yeux est sauvée par une manipulation génétique permettant de réprimer cette voie (Figure, C-C’’).
Ces résultats permettent de mieux comprendre le rôle des cils primaires dans le développement du cerveau antérieur. Ils appellent un examen plus approfondi des défauts du cerveau antérieur dans les ciliopathies humaines et la recherche de gènes de ciliopathies dans des maladies humaines affectant le développement de cette région du cerveau, comme les holoprosencéphalies.
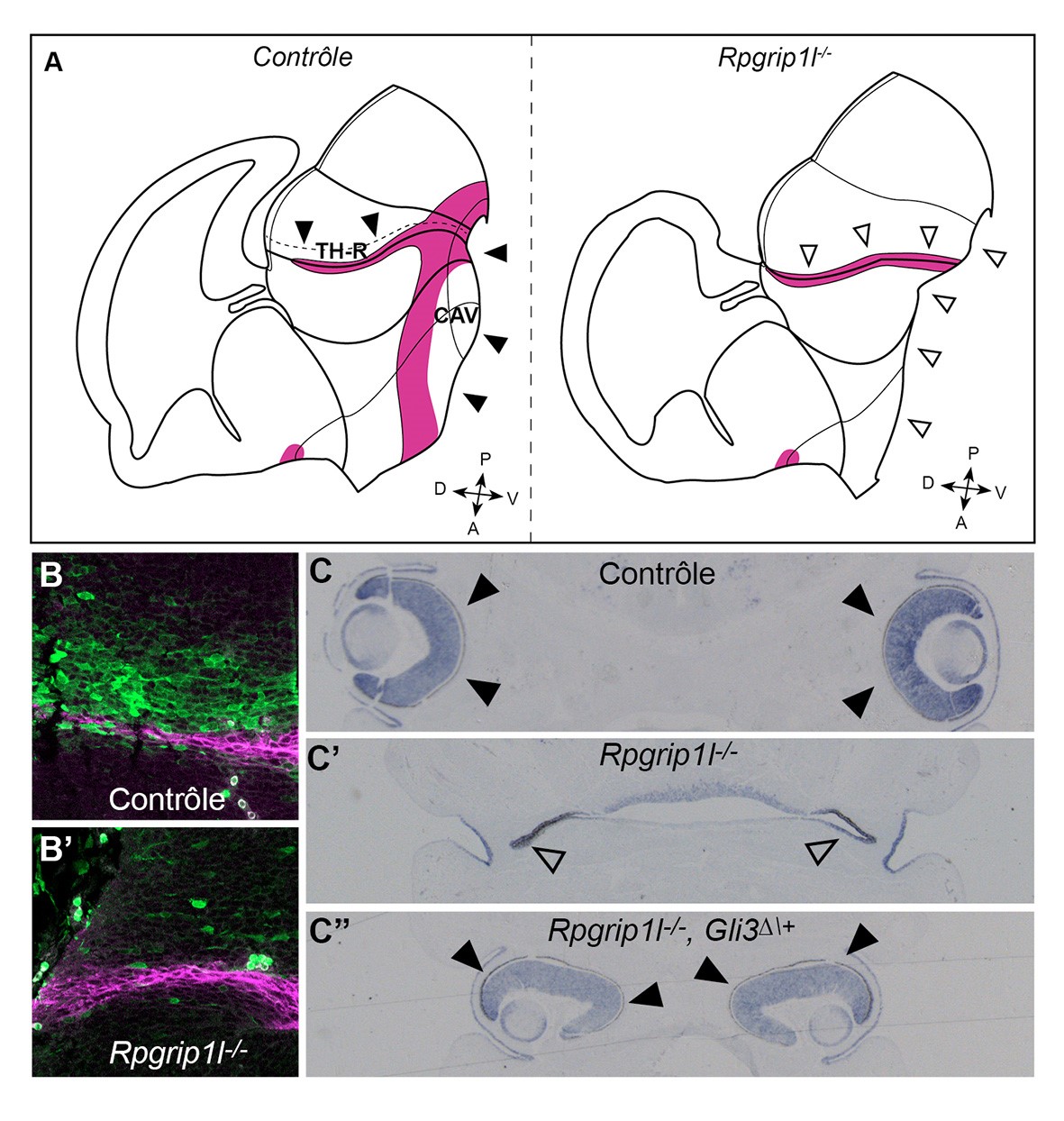
Figure. A) Schéma de l’organisation du cerveau chez un fœtus contrôle (à gauche) et mutant Rpgrip1l (Rpgrip1l-/-, à droite). Têtes de flèches : structures présentes chez le contrôle (flèches noires) et manquantes chez le mutant (flèches vides). Le cerveau antérieur ventral (CAV) est absent, ainsi que le thalamus rostral (TH-R). Les régions en magenta sont celles qui produisent le ligand Shh. B, B’) Dans le thalamus, les cellules produisant le ligand Shh (magenta) sont présentes chez le mutant mais les cellules voisines qui normalement répondent au signal (réponse mise en évidence par la fluorescence verte en B) ne répondent plus (B’). C-C’’) les yeux (têtes de flèches noires en C) ne se forment pas chez le mutant Rpgrip1l (têtes de flèches vides en C’). Lorsque la voie Hh est réprimée par croisement avec le mutant Gli3∆\+, les yeux se forment de nouveau, mais sont rapprochés l’un de l’autre (têtes de flèches noires en C’’).
En savoir plus
The ciliopathy gene ftm/rpgrip1l controls mouse forebrain patterning via region-specific modulation of hedgehog/gli signaling.
Andreu-Cervera A, Anselme I, Karam A, Laclef C, Catala M, Schneider-Maunoury S.
J Neurosci. 2019 Jan 28. pii: 2199-18. doi: 10.1523/JNEUROSCI.2199-18.2019.