Perte de poids et maladie : comment le cerveau réduit-il l’appétit et le stockage énergétique ?
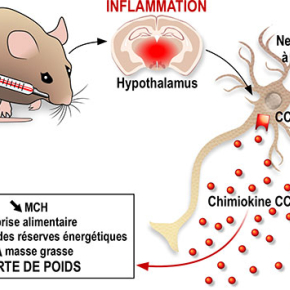
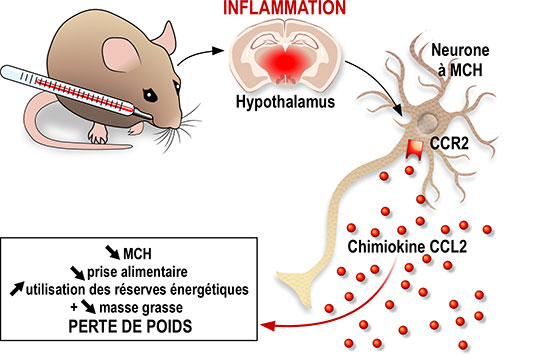
Comment lier un état inflammatoire aigu à la perte d’appétit et de poids? Une équipe de l’Institut de pharmacologie moléculaire et cellulaire, en concertation avec deux autres groupes, met en évidence une nouvelle voie de contrôle reliant l’induction d’un choc inflammatoire, la production cérébrale de la chimiokine CCL2, et l’inhibition des neurones produisant la « Melanin concentrating hormone » dans l’hypothalamus, une zone du cerveau contrôlant notre balance énergétique. Cette étude pionnière sur les signaux neuro-immunologiques contrôlant notre poids est publiée dans la revue EMBO Reports.
Chacun l'a expérimenté ou l'expérimentera : atteints d'une maladie générant un état inflammatoire plus ou moins fort, nous perdons l'appétit et en conséquence, nous perdons du poids.Afin de mieux comprendre la relation entre inflammation et perte de poids, les chercheurs reproduisent un état inflammatoire déclenché par une infection bactérienne, en injectant chez la souris un composant de la paroi de la bactérie, le lipopolysaccharide (LPS). L’injection de LPS chez la souris induit de facto une inflammation aiguë, identifiable par la surexpression de divers médiateurs inflammatoires, comme les cytokines et chimiokines. Elle est aussi associée à une fièvre et une perte de poids transitoires chez les animaux.
De nombreuses molécules inflammatoires, comme les cytokines Il1 béta, IL6 ou TNF alpha, ont été caractérisées et leurs effets démontrés dans la mise en place de ce qui est communément appelé le « comportement de maladie ». Cependant la correspondance entre la surexpression intracérébrale de ces médiateurs et leurs modes d’action sur les réseaux neuronaux impliqués dans de contrôle de l’appétit et du poids corporel restait mal définie.
Dans ce contexte, Carole Rovère et ses collaborateurs, au sein de l’équipe Génomique et Evolution en Neuro-endocrinologie dirigée par Jean-Louis Nahon, en concertation étroite avec le groupe de Nicolas Blondeau dans l’équipe de Catherine Heurteaux (IPMC/ CNRS/ UCA) et l’équipe de Serge Luquet, au laboratoire « Biologie fonctionnelle et adaptative » (CNRS/Université Paris Diderot) ont identifié une molécule inflammatoire particulière, la CCL2, comme un élément clé dans la cascade de signalisation initiée par l’administration du LPS et aboutissant à la chute d’appétit et de poids. Cette protéine appartient à la famille des chimiokines, connues pour attirer les cellules inflammatoires au site lésé et auxquelles des études scientifiques récentes ont attribué la capacité de moduler l'activité neuronale. Elle est impliquée de fait dans certaines pathologies neurologiques.
En empêchant CCL2 de jouer son rôle par des d’agents pharmacologiques ou en utilisant des modèles d’animaux transgéniques, les chercheurs ont montré que l’effet amaigrissant associé à l’inflammation induite par le LPS était notablement diminué.
Les effets du LPS, qui entraîne une perte d’appétit, une augmentation de la consommation des réserves énergétiques contenues dans la masse grasse et donc une perte de poids, sont quant à eux retrouvés lors de l’injection intracérébrale de CCL2, confirmant ainsi le rôle central de CCL2 dans l’adaptation métabolique à l’inflammation chez la souris.
Les chercheurs ont ensuite identifié la cible de CCL2 dans l’hypothalamus, une zone du cerveau décrite comme le chef d’orchestre du comportement alimentaire. L’hypothalamus est une région complexe, abritant différents types de neurones produisant des molécules capables de moduler positivement ou négativement la prise alimentaire et les dépenses énergétiques. Parmi ceux-ci se trouvent les neurones produisant la « Melanin concentrating hormone » (MCH), un peptide connu pour favoriser la prise alimentaire et réduire les dépenses énergétiques.
En approfondissant leur recherche, les chercheurs ont montré que CCL2 peut agir directement sur les neurones, en se liant à son récepteur CCR2, et diminuer leur activité ainsi que leur capacité à sécréter le peptide MCH. Ainsi, l’action de CCL2 sur les neurones synthétisant la MCH pourrait expliquer en partie la perte d’appétit, l’augmentation des dépenses énergétiques et la perte de poids associées à un état d’inflammation. Cependant d’autres réseaux hypothalamiques, voire cérébraux, seraient la cible de cette chimiokine. Par ailleurs, l’expression d’autres chimiokines et facteurs inflammatoires apparait modifiée après une injection de LPS. Ce sont autant de cibles moléculaires prometteuses pour établir de nouvelles thérapies dans le contexte d’une perte de poids non-consécutive à un régime amaigrissant ou une anorexie mentale.
En conclusion, cette étude, combinant de multiples échelles d’investigation, représente l’exemple le plus détaillé de l’identification d’un mécanisme neuro-immunologique qui pourrait être commun à de nombreuses pathologies inflammatoires. De fait, nous ne sommes qu’aux prémices de l’exploration fonctionnelle des molécules inflammatoires cérébrales responsables des changements comportementaux observés lors d’une stimulation de la réponse immunologique.
© Franck Aguila
En savoir plus
-
Central CCL2 signaling onto MCH neurons mediates metabolic and behavioral adaptation to inflammation.
Le Thuc O, Cansell C, Bourourou M, Denis RG, Stobbe K, Devaux N, Guyon A, Cazareth J, Heurteaux C, Rostène W, Luquet S, Blondeau N, Nahon JL, Rovère C.
EMBO Rep. 2016 Oct 12. pii: e201541499.