Libération anormale de progéniteurs adipeux: quand le gras est sous pression !
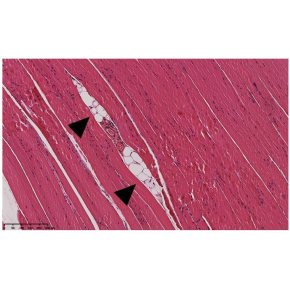
La présence d’adipocytes ectopiques dans le muscle est connue pour être délétère pour le métabolisme. Jusqu’à présent il était admis que ces cellules graisseuses provenaient de la maturation d’une population locale de progéniteurs adipeux. Cette étude publiée dans Cell Reports montre que chez la souris dans un contexte de surcharge calorique le tissu adipeux sous cutané libère de façon anormale des progéniteurs adipeux migrant vers le muscle, qui participent à la formation d’adipocytes ectopiques et aux dommages métaboliques associés.
Le tissu adipeux possède une plasticité remarquable qui lui permet de s’adapter à de fortes variations de stockage énergétique. Cette capacité, reposant sur l’augmentation de la taille et du nombre d’adipocytes, est cependant limitée et en situation prolongée de déséquilibre énergétique il est fréquent d’observer une accumulation de lipides dits « ectopiques » car non associés à un tissu adipeux. C’est notamment le cas dans le muscle squelettique où, outre l’apparition de petites gouttelettes lipidiques au sein des fibres musculaires, de véritables cellules graisseuses se forment entre les fibres musculaires et sont associés à des désordres métaboliques tels que la résistance à l’insuline.
Les chercheurs ayant précédemment montré chez la souris que le tissu adipeux sous cutané était capable de libérer des progéniteurs adipeux dans la circulation, ils ont émis l’hypothèse que les adipocytes ectopiques du muscle pouvaient provenir de ces précurseurs mobilisés. Pour tester cette hypothèse, ils ont délibérément provoqué la libération répétée de progéniteurs adipeux chez la souris en ciblant pharmacologiquement avec l’AMD3100 le système responsable de l’ancrage de ces cellules dans le tissu adipeux (c’est-à-dire la cytokine CXCL12 et son récepteur CXCR4). Ils ont alors observé que les progéniteurs adipeux relargués s’étaient infiltrés dans le muscle pour former des adipocytes ectopiques altérant le métabolisme du glucose au même titre qu’un régime enrichi en graisse. Donc, même en l’absence de surcharge calorique, la libération provoquée de précurseurs adipocytaires est suffisante pour mimer la formation d’adipocytes ectopiques observée au cours du régime gras et les dégradations métaboliques associées.
Les chercheurs ont ensuite essayé de moduler cet événement en limitant la libération de ces progéniteurs, dans l’objectif de diminuer la formation délétère des adipocytes ectopiques dans le muscle. Les souris nourries avec un régime gras et ayant reçu un traitement intermittent de Pioglitazone, un anti-diabétique ayant également des effets sur l’axe CXCL12/CXCR4, ont présenté une diminution sensible de la quantité d’adipocytes ectopiques. Les effets de la molécule d’une part augmentent la rétention des progéniteurs adipeux au sein même du tissu adipeux et d’autre part diminuent les capacités migratoires de ces cellules.
Dans le cadre des désordres métaboliques associés à l’obésité, cette étude pourrait aider à comprendre la régulation de la migration de progéniteurs adipeux vers les muscles squelettiques et ouvrir de nouvelles stratégies thérapeutiques. D’autre part, elle permet d’envisager la quantification des progéniteurs adipeux circulants comme biomarqueur diagnostique et/ou pronostique du développement des maladies métaboliques.
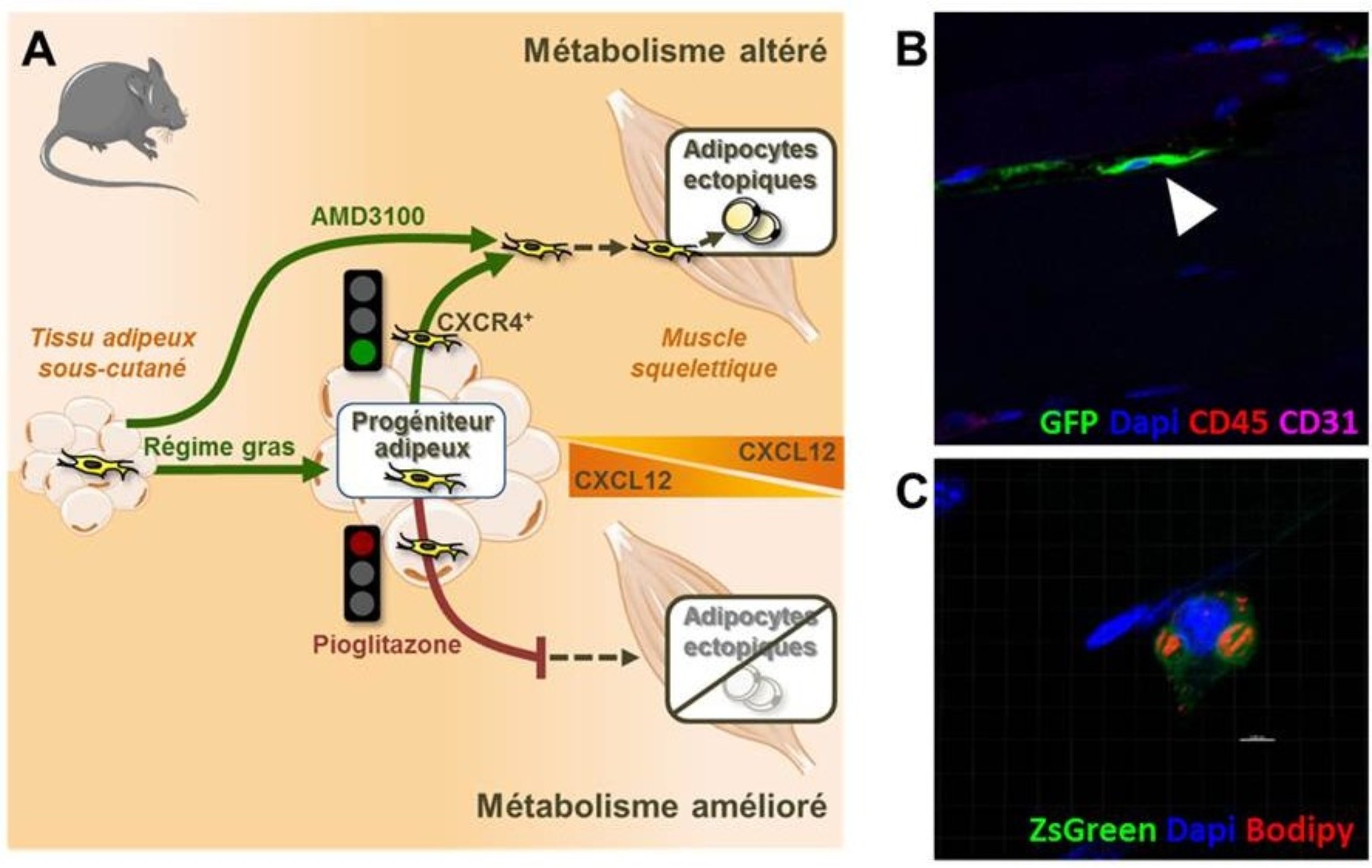
© Amandine Girousse & Coralie Sengenès
Pour en savoir plus :
The Release of Adipose Stromal Cells from Subcutaneous Adipose Tissue Regulates Ectopic Intramuscular Adipocyte Deposition.
Girousse A, Gil-Ortega M, Bourlier V, Bergeaud C, Sastourné-Arrey Q, Moro C, Barreau C, Guissard C, Vion J, Arnaud E, Pradère JP, Juin N, Casteilla L, Sengenès C.
Cell Rep. 2019 Apr 9;27(2):323-333.e5. doi: 10.1016/j.celrep.2019.03.038.