Du désordre au transport dans le remodelage des cellules neuronales, le rôle majeur joué par un domaine de type prion
Les domaines non-structurés de type prion sont présents dans des centaines de protéines. S’il a été montré que des mutations dans ces domaines favorisent l’apparition de maladies neurodégénératives, leur rôle physiologique est peu connu. Sur la base d’une analyse fonctionnelle détaillée, les chercheurs viennent de révéler le rôle essentiel d’un de ces domaines dans le transport intracellulaire de complexes ARN-protéines et le remodelage des cellules neuronales. Ces travaux sont publiés dans la revue Nature communications.
Si l’attention des chercheurs s’est concentrée pendant de nombreuses années sur la fonction des domaines protéiques structurés, il est devenu clair au cours des dernières années que des centaines de protéines contiennent des domaines sans structure propre, caractérisés par leur faible complexité de séquence. La fonction biologique de ces domaines, en particulier d’une famille de domaines partageant des similarités de séquence avec les domaines prion, connus pour leurs propriétés d’agrégation et de propagation, est largement inconnue. De façon frappante, ces domaines de type prion sont trouvés à forte fréquence dans les protéines de liaison aux ARNs faisant partie de complexes macromoléculaires riches en ARN et protéines : les granules ribonucléoprotéiques ou RNP. L’intégrité de ces domaines semble primordiale car de nombreuses mutations dominantes à l’origine de maladies neurodégénératives telles que la sclérose latérale amyotrophique ont été récemment identifiées dans ces domaines. Ces mutations induisent un changement d’état biophysique et favorisent la transformation des granules RNP normalement dynamiques en agrégats hyperstables toxiques perturbant la régulation spatio-temporelle des ARNs, et ainsi les fonctions neuronales.
Si les domaines de type prion sont enclins à accumuler des mutations délétères, pourquoi les conserver au cours de l’évolution et les enrichir au sein des granules RNP ? Afin de déterminer la fonction biologique de ces domaines dans le contexte du système nerveux, les chercheurs ont étudié chez la drosophile le rôle du domaine de type prion d’une protéine de liaison aux ARNs conservée au cours de l’évolution : la protéine Imp. Cette protéine forme avec ses cibles ARN et ses partenaires protéiques des granules RNP transportés, lors de la maturation du système nerveux, jusqu’aux axones de neurones en cours de réorganisation morphologique. De plus, Imp est indispensable à ce remodelage. Quel est le rôle de son domaine de type prion dans ce contexte ?
Afin de répondre à cette question, les chercheurs ont généré des individus exprimant une forme de Imp dépourvue de domaine de type prion. Des défauts de remodelage neuronal, accompagnés d’un blocage du transport des granules RNP Imp le long des axones ont été observés chez ces individus. De façon frappante, le rôle positif du domaine de type prion dans le transport des granules RNP ne dépend pas de l’arrangement des acides aminés au sein de ce domaine car des formes où les acides aminés sont disposés dans un ordre aléatoire localisent correctement. De plus, ce domaine peut induire par lui-même une localisation axonale après greffage à une autre protéine. Enfin, les chercheurs ont montré que la fonction de transport du domaine de type prion n’est pas liée à un changement des propriétés biophysiques (dynamique, agrégation) des granules RNP dont il fait partie, contrairement au modèle dominant dans le domaine.
En mettant en lumière l’importance physiologique d’un domaine de type prion dans la maturation du système nerveux, ces travaux ouvrent de nouvelles perspectives sur la fonction de cette partie longtemps ignorée du protéome dans des contextes sains ou pathologiques.
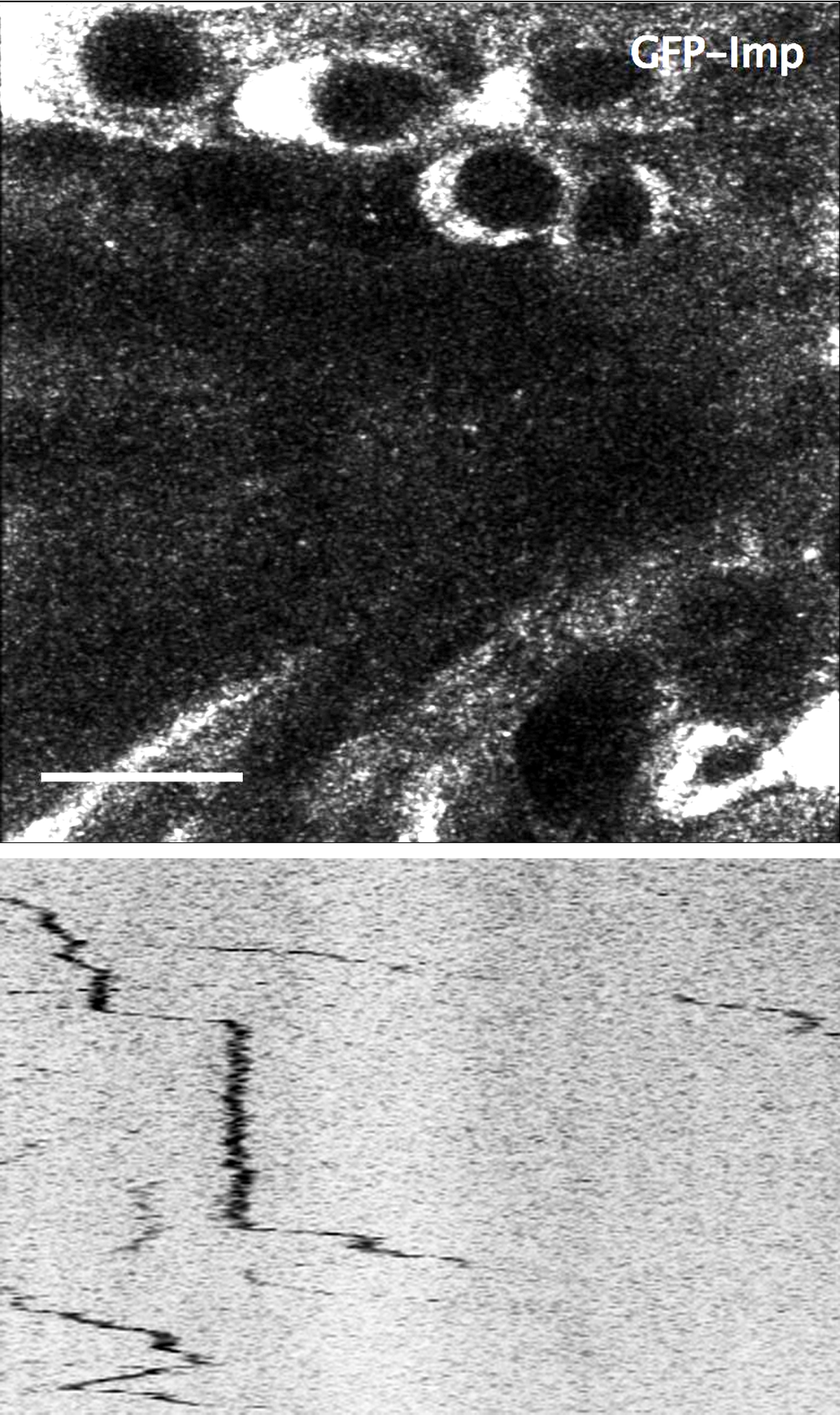
Haut : Extrait d’une vidéo montrant le mouvement des granules marquées par une protéine fluorescente GFP - VOIR EXTRAIT VIDEO
Bas : Trajectoire des granules.
© Jeshlee Vijayakumar et Florence Besse
Pour en savoir plus :
The prion-like domain of Drosophila Imp promotes axonal transport of RNP granules in vivo
Vijayakumar J, Perrois C, Heim M, Bousset L, Alberti S, Besse F
Nature Communications, 13 June 2019, https://doi.org/10.1038/s41467-019-10554-w
Site de l'Institut de biologie Valrose (iBV), portrait de Florence Besse : http://ibv.unice.fr/research-team/besse/