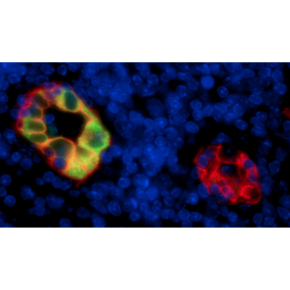
Des vaisseaux sanguins atypiques acheminent les lymphocytes dans les ganglions
Afin de lutter contre les infections virales et bactériennes, les lymphocytes circulant dans le sang pénètrent dans les ganglions lymphatiques en se faufilant à travers les vaisseaux sanguins HEV (veinules à endothélium épais). En utilisant des approches de séquençage d’ADN sur cellule unique, les chercheurs viennent de mettre à jour les caractéristiques des cellules endothéliales qui tapissent la paroi des vaisseaux HEV. Ces travaux ont été publiés dans la revue Cell Reports.
Les vaisseaux sanguins HEV constituent des portes d’entrée très efficaces puisque l’on estime que dans l’organisme, à chaque seconde au moins 5 millions de lymphocytes entrent dans les ganglions via les vaisseaux HEV. Des vaisseaux HEV apparaissent dans la plupart des maladies inflammatoires chroniques (polyarthrite rhumatoïde, maladie de Crohn, dermatite atopique, psoriasis, asthme, …) et contribuent à l’inflammation du tissu. A l’inverse, dans le cancer, les vaisseaux HEV ont un effet bénéfique car ils facilitent l’entrée dans les tumeurs solides des lymphocytes tueurs. Mais il n’est pas si facile de comprendre les caractéristiques qui distinguent les vaisseaux HEV des vaisseaux sanguins classiques. En effet, les cellules endothéliales des vaisseaux HEV sont très rares (moins de 0.02% des cellules d’un ganglion lymphatique normal) et elles sont très difficiles à isoler car elles s’accrochent aux autres cellules du tissu, notamment les lymphocytes, ce qui n’est pas vraiment une surprise car la fonction première des cellules HEV est justement de capturer les lymphocytes.
En combinant plusieurs technologies de pointe, les chercheurs sont parvenus à caractériser les cellules HEV au niveau individuel. Ils ont mis à jour une hétérogénéité des vaisseaux HEV insoupçonnée jusqu’alors, concernant notamment l’expression de protéines impliquées dans la capture des lymphocytes. Ils ont également observé que les cellules endothéliales des vaisseaux HEV, contrairement à celle des autres vaisseaux sanguins, sont activées en permanence. Enfin, ils démontrent que lorsque le ganglion lymphatique subit une inflammation, les cellules endothéliales des vaisseaux HEV modifient temporairement leur phénotype afin de permettre l’entrée dans le ganglion enflammé non seulement des lymphocytes, mais également des autres globules blancs tels que les polynucléaires.
Ces travaux pourraient avoir des applications futures dans le traitement des maladies inflammatoires chroniques et du cancer si on parvenait à bloquer la fabrication des vaisseaux HEV pour diminuer l’inflammation (maladies inflammatoires chroniques), ou au contraire à augmenter la quantité de ces vaisseaux dans les tumeurs solides afin d’améliorer l’éradication des cellules cancéreuses par les lymphocytes tueurs.
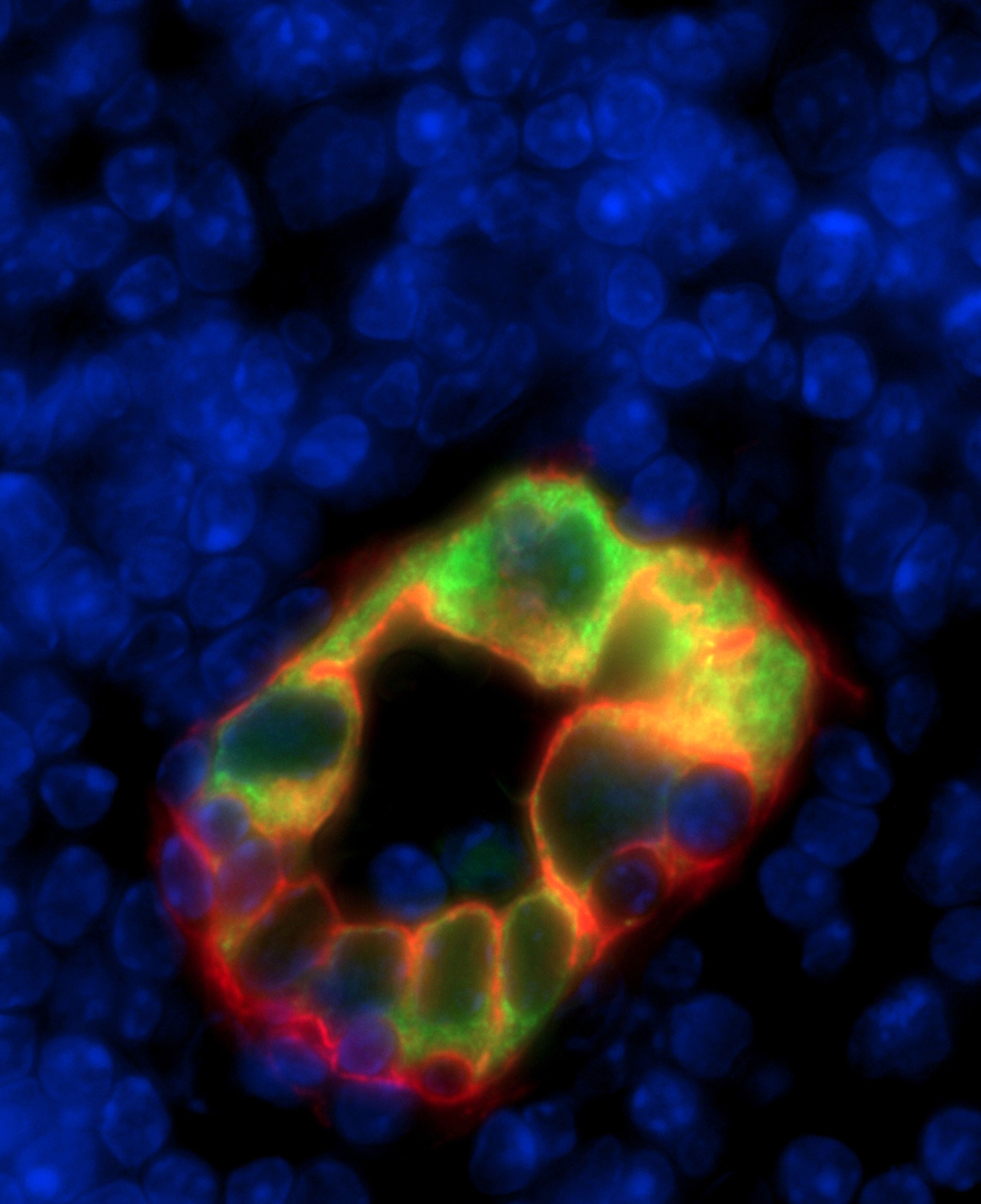
© Krystle Veerman & Jean-Philippe Girard
Pour en savoir plus :
Single-Cell Analysis Reveals Heterogeneity of High Endothelial Venules and Different Regulation of Genes Controlling Lymphocyte Entry to Lymph Nodes.
Veerman K, Tardiveau C, Martins F, Coudert J, Girard JP.
Cell Rep. 2019 Mar 12;26(11):3116-3131.e5. doi: 10.1016/j.celrep.2019.02.042.