Décryptage moléculaire d’une étape clé du processus de maturation des héparanes sulfate
La maturation des héparanes sulfate, dictée par l’action concertée d’enzymes spécifiques, est un processus essentiel pour permettre leurs fonctions biologiques. Les chercheurs ont déterminé les bases structurales du mécanisme d’action d’une épimérase qui joue un rôle majeur dans ce processus de maturation en convertissant les acides glucuroniques de l’héparane sulfate en acides iduroniques beaucoup plus flexibles. Ces travaux ont été publiés dans la revue Proc Natl Acad Sci USA.
Les héparanes sulfate, membres de la famille des glycosaminoglycanes, sont des macromolécules formées de longues chaines polysaccharidiques chargées négativement et très abondantes à la surface des cellules et dans les tissus interstitiels. En interagissant avec de très nombreuses protéines, dont ils contrôlent le mécanisme d’action, ces polysaccharides interviennent dans la plupart des grandes fonctions biologiques (morphogenèse, division, signalisation et migration cellulaires, inflammation et réponse immunitaire, angiogenèse et réparation tissulaire, etc) ainsi que dans leurs dysfonctionnements pathologiques.
Ils sont constitués de motifs glycaniques de taille variable alternant des domaines de structures assez homogènes et dépourvues de groupements sulfate avec des domaines de structures hétérogènes et fortement sulfatés. Ces sulfates, greffés sur le polysaccharide par action concertée d’enzymes spécifiques, constituent les zones de reconnaissance des protéines liant les héparanes sulfate et sont essentielles pour spécifier les diverses fonctions biologiques du polysaccharide. Cependant, les mécanismes moléculaires associés à la biogénèse et la maturation de ces domaines sulfatés sont encore mal documentés.
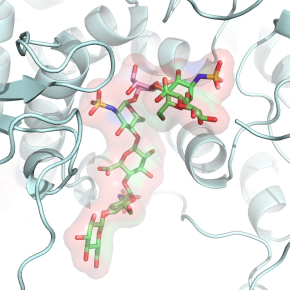
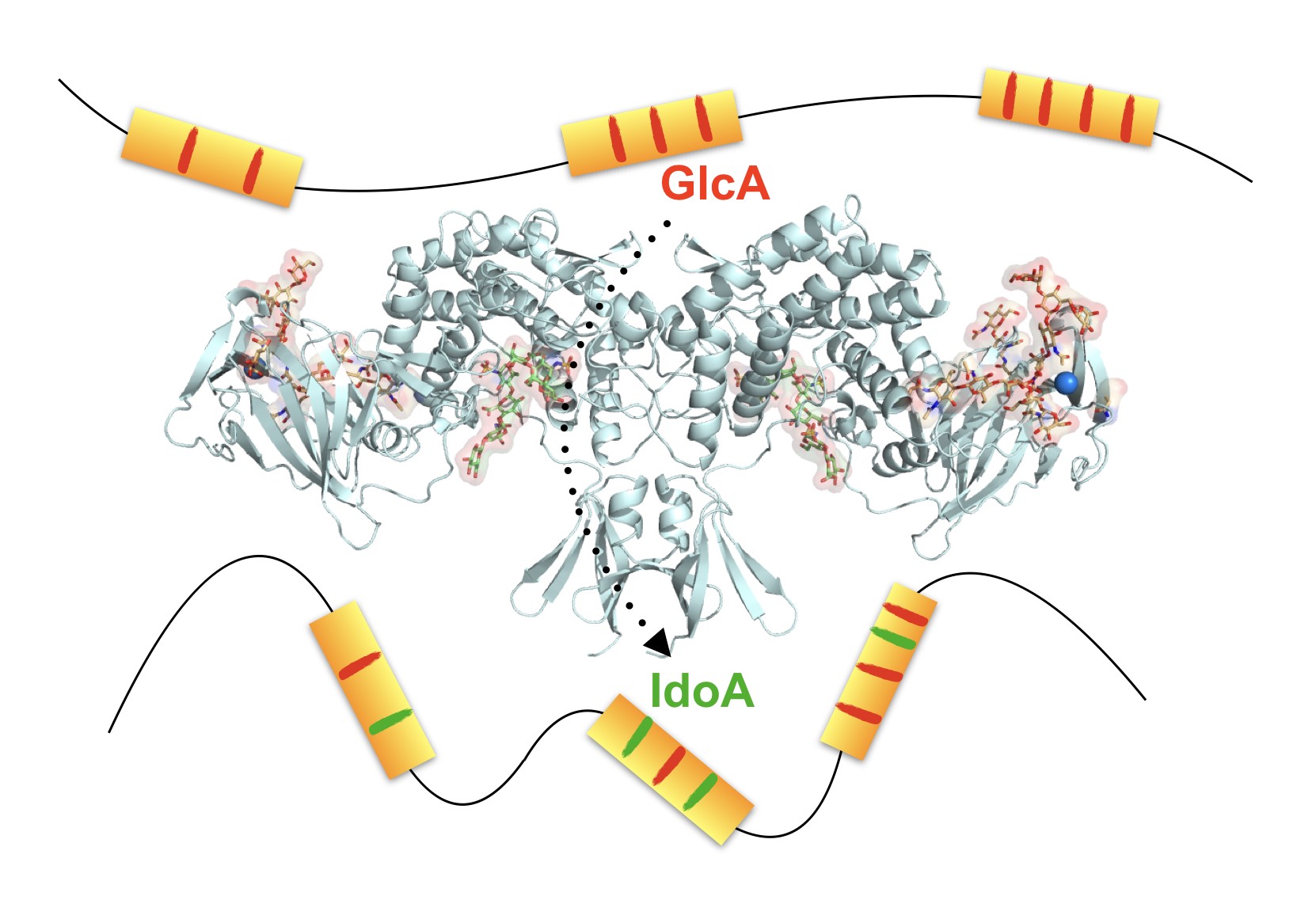
Les chercheurs ont élucidé le mode d’action à l’échelle atomique d’une enzyme majeur pour la biogenèse des héparanes sulfate: la C5-épimérase. Cette enzyme a pour spécificité de convertir, par épimérisation, les acides glucuroniques (GlcA) en acides iduroniques (IdoA). Cette fonction est essentielle au processus de maturation des héparanes sulfate puisque les acides iduroniques sont systématiquement présents dans les sites d’interaction du polysaccharide. En combinant des approches d’ingénierie et de chimie des polysaccharides, de biochimie des protéines et de biologie structurale (cristallographie aux rayons X), ils sont parvenus à identifier les résidus formant le site catalytique de l’enzyme, révéler les modes de liaison du substrat et du produit, et décrire le mécanisme d’action à l’échelle atomique. Celui-ci met en jeu des changements conformationnels du polysaccharide associés à des distorsions sélectives de l’entité glucuronique devant être épimérisée.
Ces résultats fournissent les bases moléculaires et mécanistiques pour la mise en place de nouvelles stratégies visant à modifier les résidus d'acide glucuronique/iduronique au niveau même du polymère et de générer, par synthèse chimio-enzymatique, des analogues d’héparanes sulfate (ou d’héparine) pour certaines applications biotechnologiques ou thérapeutiques.
© Yves Bourne
Pour en savoir plus :
Substrate binding mode and catalytic mechanism of human heparan sulfate d-glucuronyl C5 epimerase
Debarnot C, Monneau Y R, Roig-Zamboni V, Delauzun V, Le Narvor C, Richard E, Hénault J, Goulet A, Fadel F, Vivès R R, Priem B, Bonnaffé D, Lortat-Jacob H, Bourne Y.
PNAS. 2019 Feb. 19. DOI : 10.1073/pnas.1818333116