Contrôle inédit d’une modification post-traductionnelle par le calcium
L’ajout d’une molécule d’AMP, ou AMPylation, par les enzymes de la famille FIC est une modification post-traductionnelle des protéines qui contrôle une grande variété de processus cellulaires normaux et pathologiques. Il est donc essentiel que les protéines FIC soient précisément régulées, mais la nature des signaux régulateurs et leurs mécanismes d’action restent largement mystérieux. Dans un article publié dans Nature Communications, les chercheurs ont mis en évidence que deux AMPylases de la famille FIC, l’une bactérienne et l’autre humaine, sont directement régulées par le calcium, dont la fixation au cœur même du site actif contrôle la bascule entre l’ajout et l’élimination de l’AMP.
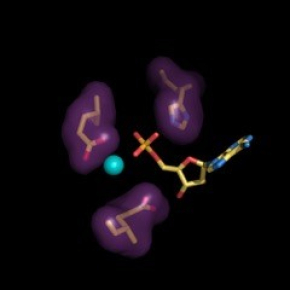
L’étude a pour origine l’observation fortuite de la présence d’un atome de calcium dans le site catalytique de l’enzyme FIC de la bactérie pathogène Enterococcus faecalis (EfFIC), lors de l'élucidation de sa structure par cristallographie aux rayons X. De façon intrigante, ce calcium occupait une position distincte de celle du magnésium habituellement observé dans le site actif de protéines FIC catalysant une réaction d’AMPylation, suggérant qu’il puisse avoir un rôle alternatif. Dans cette étude, les chercheurs montrent qu’en plus de son activité d’AMPylation, EfFIC possède aussi une activité de déAMPylation, c’est-à-dire qu’elle élimine l’AMP d’une protéine AMPylée, et que ces deux activités sont contrôlées de manière différentielle par le métal divalent (Mg2+ ou Ca2+) présent au site actif. En présence de Mg2+, les deux activités co-existent mais l’AMPylation l’emporte; en présence de Ca2+, l’activité AMPylase est inhibée, et l’enzyme se comporte comme une déAMPylase. En d’autres termes, EfFIC est en fait une enzyme bifonctionnelle, et elle utilise exactement le même site actif pour les deux réactions, mais pas de la même façon. Ces observations élucident le rôle d’un glutamate du site actif (appelé jusqu’ici « glutamate inhibiteur » parce que sa mutation augmente l’activité d’AMPylation) qui est en fait indispensable pour la réaction de déAMPylation. Cette découverte amène à proposer que toutes les protéines FICs qui possèdent un « glutamate inhibiteur », parmi lesquelles de nombreuses protéines et toxines bactériennes, sont en fait des enzymes bifonctionnelles, et pas seulement des AMPylases comme on le pensait jusqu’à présent.
L’étude prend un tour inattendu lorsque les chercheurs testent l’effet du calcium sur une protéine humaine apparentée de façon lointaine, FICD. FICD contrôle l’AMPylation de la protéine chaperon BiP, un régulateur clé de la réponse du réticulum endoplasmique au stress, processus aussi connu sous le nom d’unfolded protein response ou UPR et impliqué dans de nombreuses pathologies. Des travaux antérieurs avaient montré que FICD, comme ici EfFIC, présente une activité bifonctionnelle, mais un signal permettant de passer d’une activité à l’autre restait à identifier. Les chercheurs montrent ici que, comme pour EfFIC, les concentrations relatives de calcium et de magnésium contrôlent l’activité de déAMpylation de FICD, ce qui suggère in fine que FICD pourrait fonctionner comme un senseur des fluctuations du Ca2+ dans l’UPR.
Cette étude ouvre donc sur un nouveau paradigme du contrôle d’une activité enzymatique par des métaux, bouscule un dogme sur les activités et la régulation des protéines FIC, et ouvre des perspectives allant du stress bactérien à la dérégulation de l’UPR dans certaines pathologies.
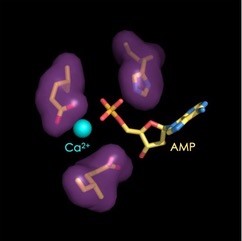
© Jacqueline Cherfils
Pour en savoir plus :
A Ca2+-regulated deAMPylation switch in human and bacterial FIC proteins.
Veyron S, Oliva G, Rolando M, Buchrieser C, Peyroche G, Cherfils J.
Nat Commun. 2019 Mar 8;10(1):1142. doi: 10.1038/s41467-019-09023-1.