Le fabuleux monde nanométrique des assemblages de peptides à portée de vue
Les assemblages peptidiques formant des hydrogels ou des fibrilles sont utilisés pour des applications biomédicales telles que la formulation de médicaments et de vaccins, la culture cellulaire et la régénération tissulaire. Pour permettre la conception rationnelle de ces peptides auto-assemblés, il faut acquérir une compréhension approfondie des règles chimiques et physico-chimiques guidant le repliement et l’assemblage de ces molécules. Avec les récents développements de la cryo-microscopie électronique (cryo-EM), la détermination de ces structures à l’échelle atomique est devenue possible. L’étude présentée permet de dévoiler par cryo-EM la structure atomique de nanotubes d'un peptide thérapeutique, le Lanréotide. Cette structure est d'une complexité que rien ne permettait de soupçonner jusqu'ici. Ces résultats sont publiés dans la revue PNAS.
Des nano- et micro-assemblages fonctionnels et polyvalents formés par des molécules biologiques se retrouvent à tous les niveaux de la vie, depuis les organites cellulaires jusqu’aux organismes complets. Comprendre les déterminants chimiques et physico-chimiques guidant la formation de ces assemblages est crucial non seulement pour comprendre les processus biologiques qu'ils mettent en œuvre mais aussi pour mimer la nature au travers de la conception rationnelle d’objets auto-assemblés exploitables notamment au niveau biomédical. Ces assemblages résultent d'interactions chimiques déterministes et sont donc tous potentiellement prédictibles. Mais actuellement nous manquons simplement d'outils pour prédire le mode d’assemblage des peptides et les architectures potentiellement polymorphes qu’ils peuvent former. Pour acquérir des outils prédictifs basés sur l’apprentissage, nous avons ainsi besoin d’identifier et comprendre un grand nombre de structures d'assemblages peptidiques.
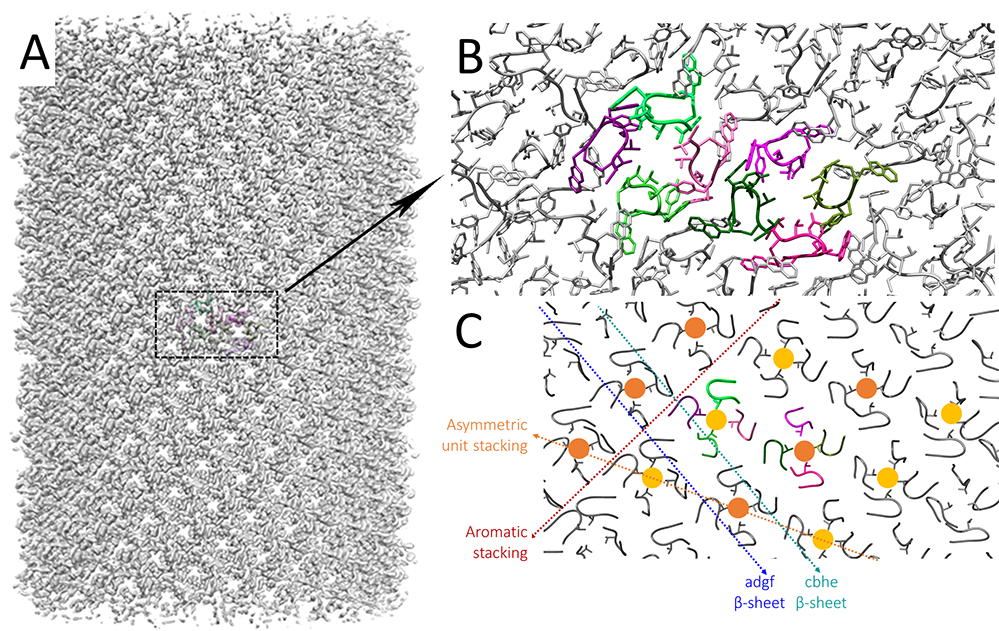
Parmi les peptides synthétiques formant des nanostructures bien définies, l'octapeptide Lanréotide a été considéré comme l'un des mieux caractérisés, tant en termes de structure que de processus d'auto-assemblage. Le Lanréotide est un peptide thérapeutique utilisé contre l’acromégalie et certains cancers neuro-endocriniens. Ce peptide s’auto-assemble spontanément dans l’eau sous forme de nanotubes de 24 nm de diamètre et extrêmement longs (de l’ordre du mm) expliquant la formation d’un hydrogel. Cet hydrogel permet au Lanréotide non seulement d’être protégé contre les dégradations chimiques mais également d’être libéré de façon contrôlée dans le temps (plus d’un mois après l’injection) assurant sa circulation continue dans le sang. La compréhension fine des règles chimiques et physicochimiques guidant les assemblages de peptides permettrait de concevoir de nouvelles formulations à libération contrôlée dans lesquelles, comme dans le cas du Lanréotide, le médicament serait sa propre formulation. Les scientifiques ont élucidé la structure atomique des nanotubes de Lanréotide obtenue à une résolution de 2,5 Å par cryo-EM. Cette structure révèle une complexité que rien ne laissait soupçonner dans les nombreux travaux antérieurs et qu’il aurait été impossible de prédire par les méthodes dont nous disposons aujourd’hui.
Le récent et phénoménal succès du logiciel d’intelligence artificielle AlphaFold pour la prédiction de la structure tertiaire des protéines n’a été possible que grâce à la base de données de structures atomiques de protéines déterminées expérimentalement. Cependant, AlphaFold n’est pas à ce stade capable de prédire les repliements et les assemblages de peptides. La vérification expérimentale de modèles à un niveau de résolution proche de l'atome doit donc devenir la norme dans ce domaine. Ce sera une étape essentielle vers le développement de méthodes prédictives fiables qui ouvrira la voie à la conception de novo de matériaux peptidiques dont les propriétés contrôlées trouveront ainsi des applications dans de nombreux domaines de la biologie, de la pharmacie et de la médecine et pourront inspirer des développements dans le domaine des nanotechnologies.
Pour en savoir plus :
Atomic structure of Lanreotide nanotubes revealed by cryo-EM
Laura Pieri, Fengbin Wang, Ana-Andreea Arteni, Matthijn Vos, Jean-Marie Winter, Marie-Hélène Le Du, Franck Artzner, Frédéric Gobeaux, Pierre Legrand, Yves Boulard, Stéphane Bressanelli, Edward H. Egelman, Maité Paternostre
PNAS 25 janvier2022. https://doi.org/10.1073/pnas.2120346119
Contact
laboratoire
Institut de biologie intégrative de la cellule-I2BC (CNRS/Université Paris-Saclay/CEA)
1 avenue de la Terrasse,
91191 Gif-sur-Yvette
