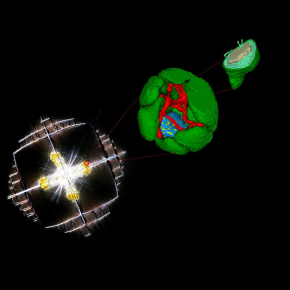
Métamorphose d’une microalgue symbiotique cultivée par son hôte
Les interactions cellulaires dans le plancton marin, comme la symbiose et le parasitisme, sont nombreuses et primordiales pour le fonctionnement des écosystèmes marins, mais restent peu connues. En utilisant des techniques de microscopie haute résolution, cette étude publiée dans la revue PNAS met en lumière les mécanismes subcellulaires par lesquels des hôtes peuvent intégrer et transformer des microalgues dans l’océan.
Les interactions cellulaires entre les organismes ont joué un rôle primordial dans l’évolution et sont déterminantes pour le fonctionnement des écosystèmes. Dans l’océan, les symbioses entre des hôtes planctoniques eucaryotes unicellulaires et des microalgues (photosymbiose) sont des phénomènes répandus et importants sur le plan écologique. Ces interactions cellule-cellule sont essentielles à la biogéochimie globale des océans et leur rôle devrait s'accroître avec l'expansion des régions pauvres en nutriments due au changement climatique. La photosymbiose est également reconnue comme une étape initiale qui a pu mener à l'acquisition des plastes dans l'histoire de l'évolution des eucaryotes. Cependant, les mécanismes par lesquels les hôtes intègrent et interagissent avec leurs microalgues symbiotiques restent mal définis.
En utilisant des techniques d'imagerie subcellulaire innovantes (microscopie électronique 3D, imagerie par spectrométrie de masse) couplés à la transcriptomique et à la photophysiologie, les scientifiques ont pu montrer que les organismes hôtes (Acantharia) reconfigurent l'architecture cellulaire et le métabolisme de leurs microalgues symbiotiques intracellulaires (le phytoplancton marin Phaeocystis) afin de stimuler leur production d'énergie. Cette métamorphose de la microalgue, induite par son hôte, a des implications potentielles sur le cycle du carbone océanique et soulève des hypothèses évolutives sur l'acquisition des chloroplastes chez les eucaryotes. Cette étude révèle ainsi la capacité de certaines grandes cellules planctoniques à manipuler et à optimiser la machinerie bioénergétique d’autres cellules photosynthétiques.
En symbiose, la division cellulaire des microalgues symbiotiques est stoppée, et leur volume cellulaire augmente drastiquement (jusqu'à 80 fois). Les chloroplastes prolifèrent, ce qui entraîne une multiplication par 100 du volume de la machinerie photosynthétique. L'efficacité photosynthétique augmente avec la taille de la cellule et les gènes photosynthétiques sont plus fortement activés en symbiose. De plus, les microalgues symbiotiques fixent 150 fois plus de carbone que les cellules libres (en culture), une amélioration physiologique que les auteurs expliquent par une augmentation du volume (15 fois) et une réorganisation structurelle du pyrénoïde, ainsi que par la régulation des gènes impliqués dans le cycle de Calvin Benson (fixation du carbone). Ce carbone, fixé par les microalgues, est principalement alloué dans leurs multiples chloroplastes et transféré à la cellule hôte. En parallèle, les mitochondries se transforment en un réseau réticulé étendu dont le volume est multiplié par 50. La modélisation de la propagation des photons montre que ce réseau mitochondrial réticulé augmente la diffusion de la lumière dans la cellule et donc optimise la capture des photons pour la photosynthèse.
La métamorphose des chloroplastes et des mitochondries met en évidence le potentiel de transformation de la machinerie bioénergétique d'une cellule photosynthétique par une cellule hôte. De façon remarquable, le contrôle de l'hôte se manifeste également par l'invagination du symbiosome (la vacuole de l'hôte contenant les microalgues) à l'intérieur de la microalgue, très probablement pour optimiser les échanges métaboliques. Cette profonde transformation de l'algue ajoute des preuves au concept de "cytoklepty" (vol de cellule ou farming) dans le plancton océanique, selon lequel l'hôte détourne et « parasite » des microalgues, qui sont transformées à un point tel qu'elles sont incapables de revenir à leur forme de vie libre. Cette étude démontre l’intérêt d’aller scruter d’autres interactions cellulaires dans le plancton à l’échelle nanométrique pour comprendre comment les cellules vivent dans cet océan pauvre en nutriments et manipulent d’autres cellules pour accéder à des ressources énergétiques.
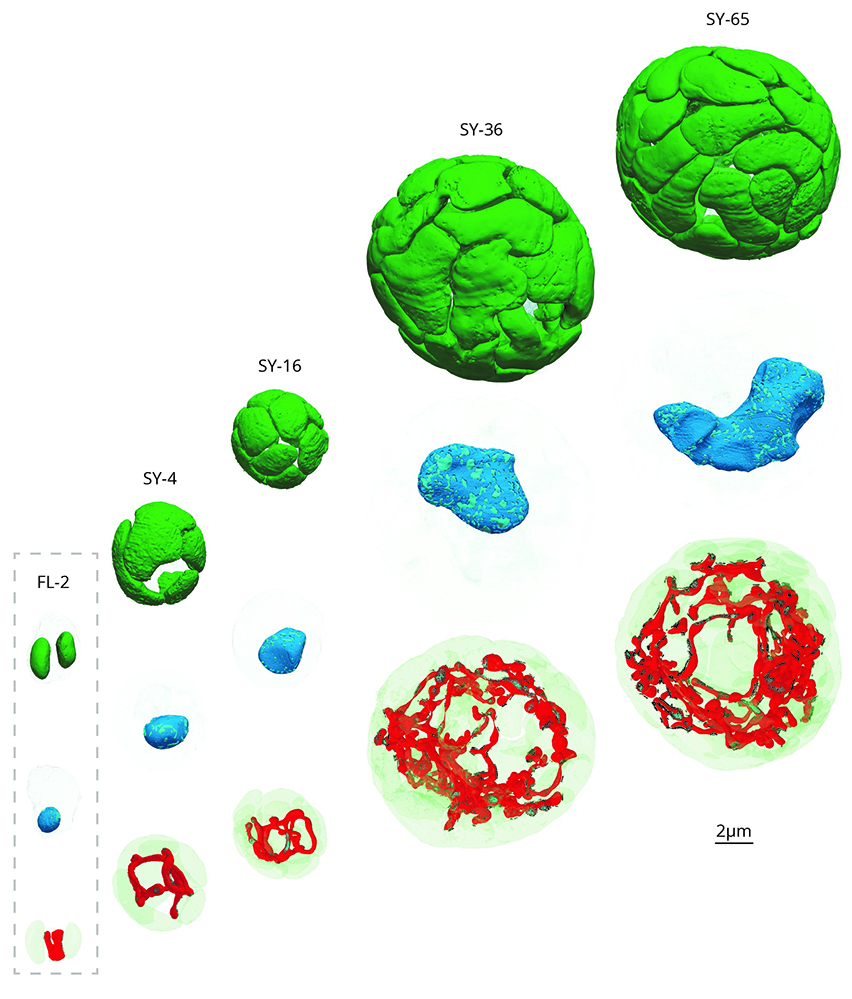
Figure : Transformation d’une microalgue en symbiose (SY) par rapport à son mode libre (FL). En symbiose, à l’intérieur d’un hôte, ses chloroplastes (vert) se multiplient (jusqu’à 65), sa division cellulaire est bloquée donc son noyau grossi (bleu), et sa mitochondrie (rouge) se transforme en un grand réseau.
Pour en savoir plus :
Cytoklepty in the plankton: A host strategy to optimize the bioenergetic machinery of endosymbiotic algae.
Uwizeye C, Mars Brisbin M, Gallet B, Chevalier F, LeKieffre C, Schieber NL, Falconet D, Wangpraseurt D, Schertel L, Stryhanyuk H, Musat N, Mitarai S, Schwab Y, Finazzi G, Decelle J.
Proc Natl Acad Sci U S A. 2021 Jul 6. doi:10.1073/pnas.2025252118.
Métamorphose d’une microalgue symbiotique cultivée par son hôte
Transformation d’une microalgue en symbiose par rapport à son mode libre. A l’intérieur d’un hôte, les chloroplastes (vert) se multiplient et la mitochondrie (rouge) se transforme en un grand réseau.
Audiodescription
Contact
laboratoire
Laboratoire de physiologie cellulaire et végétale (LPCV) - (CNRS/CEA/INRAE/Université Grenoble alpes)
17 rue des Martyrs
38054 Grenoble