La myosine A, une nouvelle cible potentielle pour lutter contre le paludisme
Le paludisme, dont le vecteur est le parasite Plasmodium, est une maladie qui tue encore un demi-million de personnes par an et un problème de santé publique majeur. Dans un article paru dans le journal Elife, les scientifiques ont fait une avancée majeure en décrivant -dans le détail- le mécanisme d’action de la myosine A, un moteur moléculaire essentiel pour l’infection par le Plasmodium. Ces résultats ouvrent une nouvelle voie dans la conception de traitements antipaludiques visant spécifiquement ce moteur.
Le paludisme – aussi appelé malaria – est une maladie parasitaire due aux protozoaires du genre Plasmodium. Ces parasites ont un cycle de vie complexe alternant des stades mobiles capables de migrer très rapidement dans l’organisme et des stades immobiles, appelés mérozoïtes, qui infectent les cellules sanguines (érythrocytes) et sont responsables des symptômes de la maladie. L’apparition d’une résistance de P. falciparum à l’artémisinine est un problème de santé publique urgent. Malgré plus d’un siècle de recherche, les médicaments sont rares et ces parasites développent des résistances à tous les traitements.
La capacité de ces parasites à se déplacer et à infecter les cellules de leur hôte reposent sur un moteur moléculaire très spécifique appelé la myosine A (PfMyoA chez P. falciparum) qui fait partie d’un complexe macromoléculaire appelé glideosome. Les myosines sont des moteurs moléculaires très communs dans le vivant. Elles sont impliquées dans la contraction musculaire ou dans le déplacement des cellules. Du point de vue de leur structure, les myosines sont constituées d’un domaine moteur capable d’hydrolyser de l’adénosine triphosphate (ATP) et d’un domaine adjacent appelé bras de levier. L’énergie fournie par l’hydrolyse d’ATP conduit à des changements au sein du moteur qui sont amplifiés par le bras de levier qui conduisent à la production de force.
Dans le cadre d’une collaboration avec l’Université du Vermont (États-Unis) et l’Imperial College (Royaume-Unis) les scientifiques ont décrypté le mécanisme de la myosine A dans le contexte de l’infection des cellules humaines par le parasite P. falciparum. Plusieurs structures cristallographiques de la protéine PfMyoA entière permettent de comprendre le mécanisme de production de force contrôlant le bras de levier atypique de cette protéine. Guidées par les informations structurales, les expériences de parasitologie menées à l’Imperial College ont démontré que les éléments constituants le bras de levier sont essentiels à l’infection des cellules sanguines par le parasite, et donc à la progression de la maladie.
Ces travaux désignent la myosine A comme une cible thérapeutique de choix pour le développement de nouveaux traitements anti-paludéens. Les structures cristallographiques de PfMyoA ouvrent la voie vers la conception rationnelle de petites molécules inhibitrices capables de bloquer spécifiquement l’action de ce moteur essentiel pour le pathogène.
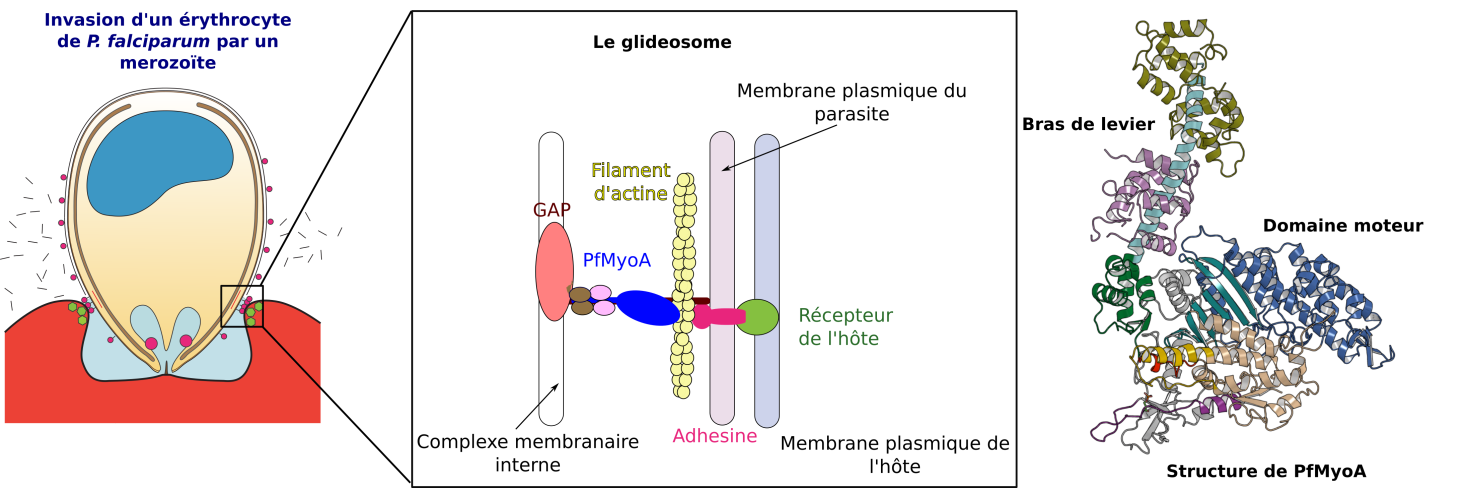
Figure : Invasion d’un erythrocyte par un mérozoïte de P. falciparum. PfMyoA est un élément central d’un complexe macromoléculaire appelé le glideosome. À droite : structure cristallographique de PfMyoA.
Pour en savoir plus :
Full-length Plasmodium falciparum myosin A and essential light chain PfELC structures provide new anti-malarial targets.
Moussaoui D, Robblee JP, Auguin D, Krementsova EB, Haase S, Blake TCA, Baum J, Robert-Paganin J, Trybus KM, Houdusse A.
Elife. 2020 Oct 13;9:e60581. doi: 10.7554/eLife.60581.
Contact
Laboratoire
Biologie cellulaire et cancer (CNRS/Sorbonne Université)
& Institut Curie,
12 rue Lhomond 75005 Paris, France