Ne m’appelez pas par mon nom ! NMT dévoile un double jeu.
Les Glycylpeptide N-tétradecanoyltransférases (NMT) sont des enzymes clés responsables de la myristoylation (MYR), une modification essentielle de nombreuses protéines majeures de la cellule. Cet article publié dans la revue Nature Communications rapporte la découverte d’un nouveau mécanisme catalytique des NMT capable de prendre en charge la modification à la fois des glycines et des lysines N-terminales, un site d’ancrage encore inconnu. Ces informations sont particulièrement précieuses pour le développement d’inhibiteurs avec une sélectivité améliorée pour cette cible validée pour plusieurs pathologies infectieuses comme le rhume, le paludisme et d’autres maladies tropicales.
Les glycine myristoyl transférases N-terminales (NMT) sont connues depuis plus de trente ans. Ce sont des enzymes évolutivement conservées responsables de la myristoylation (MYR), une modification lipidique majeure des protéines affectant des protéines-cibles clés des voies de transduction cellulaires. Les NMT sont connues pour cibler spécifiquement des glycines N-terminales de protéines et sont répertoriées logiquement dans la nomenclature comme Glycylpeptide N-tetradecanoyltransferase (EC 2.3.1.97). Les NMT étant impliquées dans des processus physiopathologiques variés, ce sont aussi des cibles médicamenteuses très prometteuses, quoique le développement de médicaments soit rendu plus complexe du fait d’une caractérisation très approximative du mécanisme enzymatique.
En combinant de nouvelles structures radio-cristallographiques, des analyses cinétiques et des caractérisations de produits de réaction par spectrométrie de masse, les scientifiques, en collaboration avec une équipe de l'Imperial College de Londres ont élucidé les différentes étapes du mécanisme catalytique de la NMT humaine. Les structures cristallines du catalyseur avec des substrats réactifs révèlent des instantanés à résolution atomique de l'ensemble du mécanisme catalytique, de l’état initial à l’état final. Un film permet de visualiser au ralenti toute la réaction qui normalement se déroule en une fraction de seconde. Les auteurs montrent comment la NMT atteint une conformation chimiquement compatible avec la catalyse où les groupes réactifs sont suffisamment rapprochés pour permettre la réaction.
Cette analyse a fourni le premier indice que le NMT pourrait également transférer le lipide non seulement à la glycine N-terminale mais aussi à des résidus de lysine spécifiques des protéines cibles. Dans une deuxième partie du travail, les scientifiques ont pu démontrer la lipidation réelle de lysines N-terminales, élargissant de manière décisive la gamme de substrats connus de cette enzyme et démontrant que la NMT1 humain est la première lysine myristoyltransférase identifiée à ce jour.
Le nouveau mécanisme offre des informations très précieuses pour le développement futur d'inhibiteurs avec une sélectivité améliorée. En effet, les auteurs suggèrent que les inhibiteurs de la NMT pourraient être rendus plus efficaces et sélectifs en remodelant l'interaction avec le groupe carboxyle C-terminal de l'enzyme pour aider à repositionner une amine primaire à réagir avec l'un des deux substrats de l'enzyme pour générer un inhibiteur de NMT.
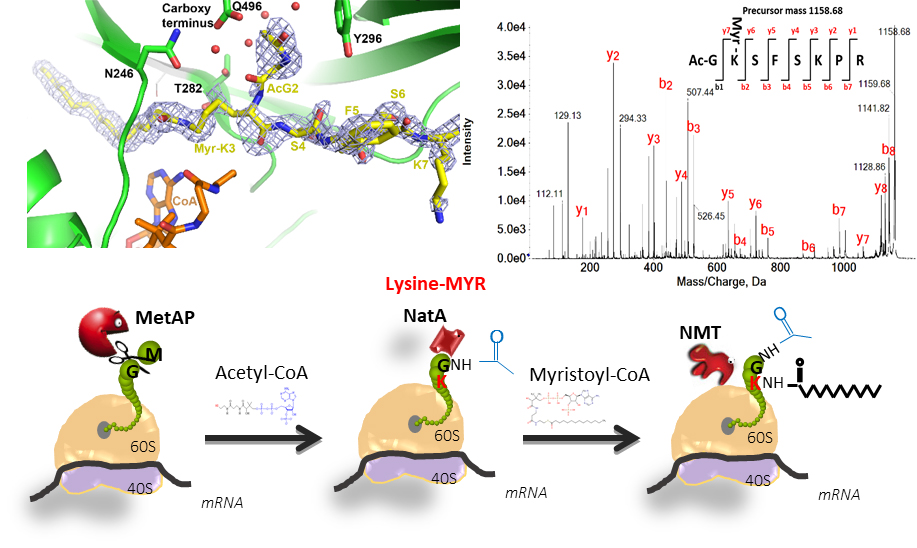
Figure : Myristoylation d’une Lysine N-terminale. En haut à gauche, structure cristalline du complexe HsNMT1/Ac-GKSFSK montrant la myristoylation de la Lysine 3. En haut à droite, spectres MS/MS résultant de l'analyse MALDI-ToF-ToF du peptide AcGKSFSKPR préalablement incubé avec NMT. En bas, illustration de la réaction de N-myristoylation.
Ne m’appelez pas par mon nom ! NMT dévoile un double jeu.
Audiodescription
Pour en savoir plus
High-resolution snapshots of human N-myristoyltransferase in action illuminate a mechanism promoting N-terminal Lys and Gly myristoylation.
Dian C, Pérez-Dorado I, Rivière F, Asensio T, Legrand P, Ritzefeld M, Shen M, Cota E, Meinnel T, Tate EW, Giglione C.
Nat Commun. 2020 Feb 28;11(1):1132. doi: 10.1038/s41467-020-14847-3
Contact
Laboratoire
Institut de Biologie Intégrative de la Cellule (I2BC) - (CNRS/CEA/ Université Paris-Saclay)
91198 Gif-sur-Yvette
France