Nano-Vision de l’assemblage du VIH-1 : gare de triage des lipides !
Le virus VIH-1, responsable du SIDA, infecte les lymphocytes T CD4 et produit des particules virales, d’une centaine de nanomètres, qui bourgeonnent de la membrane de la cellule infectée. Le virus acquiert ainsi une enveloppe lipidique qui dérive de la cellule hôte. En appliquant une technique optique novatrice (nanoscopie de fluctuation sur lymphocytes T vivants infectés), les chercheurs ont pu montrer, et publier dans la revue Science Advances, que le VIH-1 trie des lipides spécifiques dans la membrane de la cellule en créant ainsi une nouvelle plateforme d’assemblage, véritable « usine à virus » !
Au cours de la phase de production des particules du virus de l’immunodéficience humaine de type 1 (VIH-1), les protéines Gag du virus s’assemblent et le virus bourgeonne à partir de la membrane plasmique de la cellule infectée. La composition lipidique de l’enveloppe du VIH-1 est cependant différente de celle de la membrane cellulaire. Longtemps les chercheurs ont pensé qu’après une interaction avec un phospholipide chargé, le PI(4,5)P2, la protéine Gag du VIH-1 ciblait des zones pré-existantes de la membrane plasmique de la cellule infectée appelées « radeaux lipidiques », enrichies dans certains lipides comme la sphingomyéline et le cholésterol, dont elle profitait pour s’auto-assembler.
Dans le cadre d'une collaboration avec l’Université d’Oxford (UK) et l’Université de Jena (Germany), les chercheurs ont montré qu’un tout autre mécanisme était mis en jeu lors de l’assemblage du virus dans les cellules cibles. A l’aide d’une nouvelle méthode de microscopie photonique de super-résolution, applicable sur cellules vivantes infectées, la nanoscopie « scanning STED-FCS », ils ont mesuré et directement comparé la dynamique des différents lipides dans les sites d’assemblages du VIH-1 et en dehors de ces sites d’assemblages, directement dans la membrane des lymphocytes T CD4. Les chercheurs ont pu observé que la mobilité du PI(4,5)P2 et du cholesterol au site d’assemblage du virus dans des cellules préalablement infectées, contenant donc toute la machinerie virale, était fortement diminuée au bourgeon viral par rapport à la membrane plasmique alors que celle de la sphingomyéline, composant essentiel des domaines membranaires pré-existants restait inchangée. Finalement, en implantant à Montpellier la technique de « scanning STED-FCS », ils ont montré, dans des lymphocytes T exprimant seulement la protéine Gag du VIH-1 que, là encore, les mobilités du PI(4,5)P2 et du cholestérol étaient réduites au site d’assemblage alors que celle de la sphingomyéline restait inchangée, dévoilant ainsi l’acteur de ce phénomène. Cela démontre que le VIH-1, comme tout parasite, utilise non seulement les composants cellulaires à son avantage mais en plus il les choisit et les "kidnappe" afin de produire de nouveaux virus.
Ces résultats ont donc permis d’établir que la composition lipidique différentielle de l’enveloppe du VIH-1 n’était pas liée à son recrutement dans des sites spécialisés de la membrane plasmique de la cellule mais à la capacité de sa protéine Gag à interagir et à trier les lipides lors de son assemblage afin de créer son propre domaine membranaire. Cela ouvre de potentielles perspectives pour le traitement du virus VIH-1 notamment au niveau des étapes tardives de la réplication du virus et pour des méthodes de criblage de molécules par nanoscopie de super-résolution.
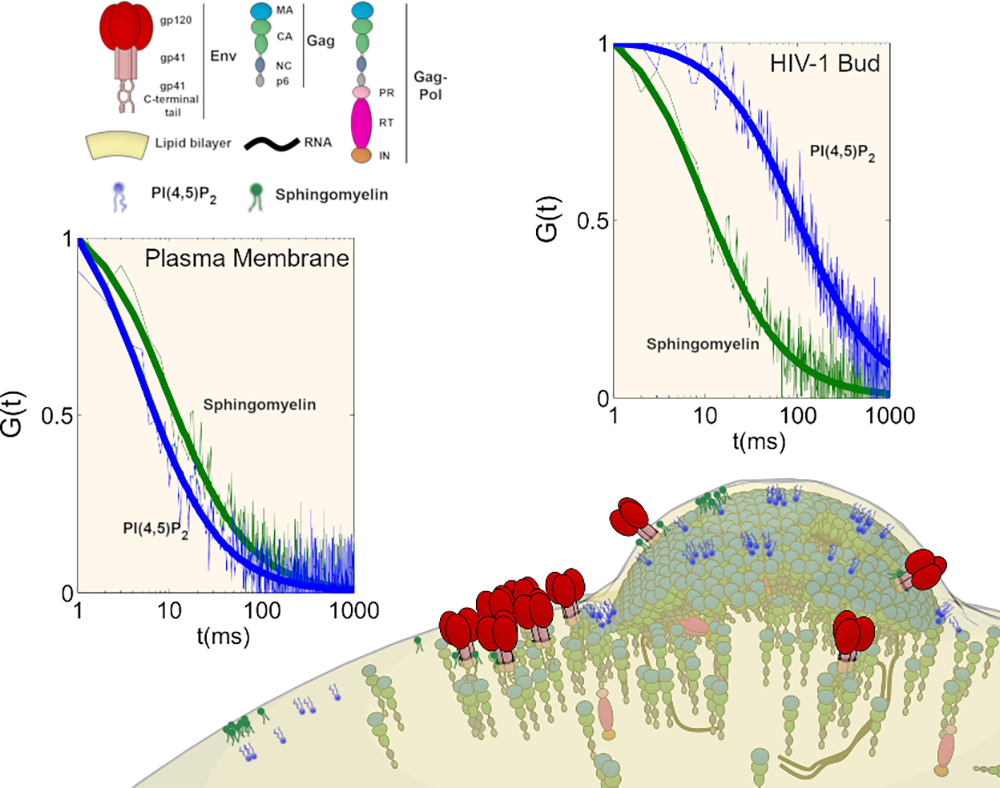
Figure : Comparaison de la mobilité des lipides dans la membrane de la cellule infectée par le VIH-1 au site d’assemblage (« HIV-1 Bud ») et en dehors (« Plasma Membrane ») grâce à des mesures effectuées par la technique de nanoscopie « scanning STED-FCS » directement sur cellules infectées vivantes. Dans la membrane plasmique, le phospholipide PI(4,5)P2 (courbe bleue) diffuse plus rapidement que la sphingomyeline (courbe verte) alors que dans le site d’assemblage du virus, si la diffusion de la sphingomyeline reste identique, celle du PI(4,5)P2 est fortement ralentie (courbe bleue) indiquant une capture du phospholipide par le virus dans la membrane de la cellule infectée.
Pour en savoir plus :
HIV-1 Gag specifically restricts PI(4,5)P2 and cholesterol mobility in living cells creating a nanodomain platform for virus assembly.
Favard C, Chojnacki J, Merida P, Yandrapalli N, Mak J, Eggeling C, Muriaux D.
Science Advances, Oct 2nd, 2019. DOI: 10.1126/sciadv.aaw8651
Contact
Collaborateurs Internationaux :
Pr. C. Eggeling, University Oxford/ University Jena
Dr. J. Chojnacki, University Oxford/ IrsiCaixa