La taille de l'univers des sucres enfin estimée !
Contrairement aux protéines, la structure des sucres complexes n’est pas codée par l’ADN mais par la spécificité des enzymes qui les assemblent. Alors que leur diversité théorique est astronomique (1012 hexasaccharides possibles), la diversité naturelle des glycanes n’a jamais été explorée. En analysant les enzymes de dégradation des sucres complexes, les chercheurs concluent que la diversité naturelle des glycanes est plusieurs ordres de grandeur inférieure à la diversité attendue. Ce travail est publié dans la revue Nature Communications.
Parmi les principales classes de biomolécules, les glycanes sont les plus abondants sur Terre et représentent la principale forme de stockage et d'échange de carbone. Cependant, la diversité naturelle des glycanes n’a jamais été explorée. Contrairement aux protéines, la structure des glycanes ne peut pas être déduite directement d'un code comme le code génétique. Les calculs théoriques ont révélé un nombre astronomique d'isomères possibles pour un hexasaccharide (plus de 1012 !), mais la diversité réelle des glycanes naturels est inconnue.
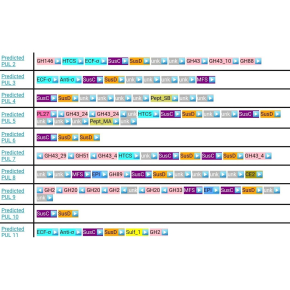
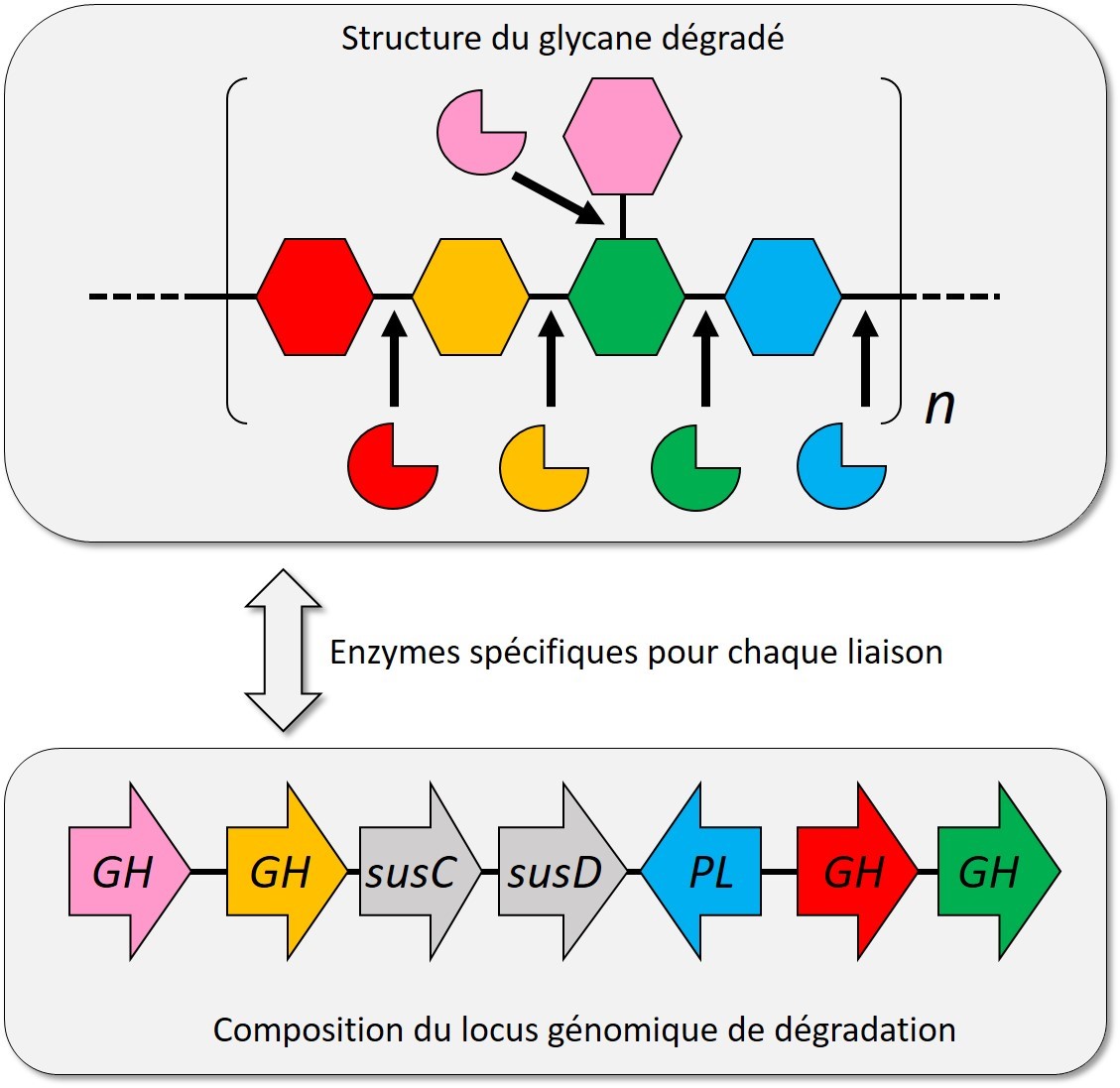
Les chercheurs ont estimé cette diversité en examinant le nombre de combinaisons d'enzymes élaborées par les bactéries du phylum Bacteroidetes pour la dégradation des glycanes. Ces bactéries, trouvées dans toutes les niches écologiques variés (système digestif animal, sol, habitats d'eau douce et marins), présentent un arrangement particulier de leurs gènes codant pour les enzymes de dégradation des glycanes. Les gènes participant à la dégradation d’un même glycane sont en effet voisins sur le génome (on parle de locus génomique) alors que les gènes participant à la dégradation de glycanes différents sont éloignés sur des loci différents. Certains Bacteroidetes peuvent ainsi posséder plus de 100 loci différents de dégradation des glycanes. Les chercheurs ont analysé de tels loci dans près de 1000 génomes de Bacteroidetes provenant d’environnements variés et ont trouvé que le nombre de combinaisons uniques d'enzymes atteint environ 3000. Ce nombre ne croît que très lentement lors de l'ajout de nouveaux génomes ou de la découverte de nouvelles familles d'enzymes de dégradation des sucres. Il est donc probable que la diversité des glycanes accessibles à la digestion par Bacteroidetes est de l'ordre de quelques milliers.
Cette diversité est à la fois énorme et minuscule. Enorme si l’on compare au très petit nombre de peptidases nécessaires à la décomposition de pratiquement toutes les protéines ou du nombre de nucléases nécessaires à la dégradation de l’ADN ou de l’ARN. Énorme également par rapport aux quelques dizaines de glycanes purifiés disponibles auprès de sources commerciales. En revanche, la diversité en glycanes dérivée de cette étude est plusieurs ordres de grandeur inférieure à la diversité théorique (1012), soulignant les contraintes qui s'appliquent à la biosynthèse des glycanes.
Cette étude est la première à rapporter une estimation de la diversité des glycanes basée sur des données biologiques. Outre son intérêt dans le domaine de la glycobiologie, cette approche pourrait permettre de prédire la présence d'un polysaccharide particulier dans un environnement qui sert de source de carbone aux bactéries, ouvrant ainsi des perspectives d'applications en écologie, biotechnologie ou biomédecine.
© Bernard Henrissat
Pour en savoir plus :
Bacteroidetes use thousands of enzyme combinations to break down glycans.
Lapébie P, Lombard V, Drula E, Terrapon N, Henrissat B.
Nat Commun. 2019 May 3;10(1):2043. doi: 10.1038/s41467-019-10068-5.